6.01-6.10
6.01
飽和な脂肪族炭化水素(アルカン)の一般式を思い出すところから始める。直線状にならんだ炭素鎖は、それぞれ4本の結合を持つがうち2つは水素と結合している(-CH2-:メチレン)。直線状にならんだ炭素鎖の両末端だけは、3つの水素と結合している(-CH3:メチル)。これを考えると、アルカンの一般式、(CH3)×2+(CH2)×m が分子式であるが、いま、m+2 を n と置いて式を整理すると、CnH2n+2 が導出される。アルカンが途中で分岐していても同じ式で表されることは、各自、構造式を描きながら確認しておくこと。
分子の中の任意の2つの水素を取り去り、その炭素同士を結合した場合、隣接していた場合には多重結合に、離れた位置だった場合には環構造となり、不飽和度が1増える。従って、注目する分子の分子式中の水素数の、アルカンの一般式との差を2で割れば不飽和度となる。
(解答例)
6.02
不飽和度の原因として、環構造と多重結合の存在がある。環構造をもたない場合、環構造を1つ持つ場合、… の順に整理し、可能な骨格構造(直線状、主鎖炭素数が1つ少なく分岐したメチル基を持つ場合、主鎖炭素数が2少なくメチル基2つまたはエチル基を持つ場合、…)をすべて書き出したのち、残りの不飽和度を多重結合(すべて二重結合で三重結合を持たない場合、三重結合を1つ持つ場合、2つ持つ場合… の順に整理する)に由来するものとして割り当てていく。
(解答例)
6.03
(解答例)
6.04
教科書 pp 180-181 の命名法を復習すること。二重結合を含んだ一番長い炭素鎖が主鎖となる。その長さのアルカン(alkane)から派生した名前をつける。アルキル置換基等よりも、二重結合の位置を優先して番号が小さくなるように位置番号を振る。C2とC3の間が二重結合である場合は、2−アルケン( 2-alkene )のように表現する。
(解答例)
6.05
(解答例)
6.06
(解答例)
6.07
(解答例)
6.08
(例)trans-2-alkene
(解答例)
6.09
(解答例)
6.10
(解答例)
(6.01-6.10 は、現在準備中です。)
6.11-6.20
6.11
(解答例)
(発展)
アルケンの E/Z の帰属には関係ないが、IUPAC名をつける際には、(a) 〜 (d) いずれも命名上アルケンよりも優先度の高い官能基を含んでいる。 E/Z 配置を除いた名称は次の通り。
(a) 2-chloro-2-penten-1-ol
(b) 1-chloro-2-ethyl-2-methoxy-1-pentene
(c) 3-hydroxy-2-(3-methylcyclopentylidene)propanoic acid
(d) 2-aminomethyl-2-butenenitrile
6.12
(解答例)
(発展)
この化合物では、ester が最優先される官能基である。
methyl 2-hydroxymethyl-3-isopropyl-2,4-pentadienoate
6.13
(解答例)
6.14
(b), (d) は、非対称なアルケンなので、臭化水素の付加反応の配向性を考える必要がある。中間体として生じるカルボカチオンの安定性により配向が決まる。(マルコフニコフ配向)
(c) リン酸とヨウ化カリウムの組み合わせは、教科書195ページにもあるように、ヨウ化水素をくわえるのと同じである。これは、リン酸から H+ が、ヨウ化カリウムから I- が与えられるためである。
(解答例)
6.15
ハロゲンの結合した炭素が2級や3級のときは、隣接炭素が複数あって二重結合を入れるべき位置に可能性がいくつかある場合には、それぞれについて、そのアルケンにプロトンを付加してカルボカチオンを生じさせるときに目的物に対応したものが生じるかどうかを確認する。
(c) は、考えられる一方のアルケンからは、安定性に差のない2種のカルボカチオンが生じるため、2種のハロゲン化アルキルの混合物となってしまうが、もう一方のアルケンからは、(対称性の関係から)1種のカルボカチオンしか生じない。
(d) は、考えられる一方のアルケンからは、2級と3級のカルボカチオンを生じるような位置であるが、その安定性の差より3級のカルボカチオンが生じるのに対し、目的とするハロゲン化アルキルは2級のカルボカチオン経由で生じるため、原料としてふさわしくない。もう一方のアルケンからは、1級と2級のカルボカチオンが生じるような位置であり、安定性の差より2級のカルボカチオンのみが生じるため、目的のハロゲン化アルキルを与える。
(b) は、考えられるアルケン2種は、いずれも2級と3級のカルボカチオンを生じるような位置であるから、3級のカルボカチオン1種のみが生じ、目的とするハロゲン化アルキルを与える。
(a) は、分子の対称性の問題より、考えられるアルケンはもともと1種類しかない。
(解答例)
6.16
カルボカチオンは、1級より2級、2級より3級が安定である。
(解答例)
6.17
カルボカチオンの電荷を担う炭素は、sp2 混成で、3配位平面形の結合を持つ。従って、図で結合が3本しかない炭素上に正電荷を持つ。その炭素の、sp2 混成に寄与しない空の p 軌道は、3本の結合のつくる平面と直交している。隣接した炭素のシグマ結合(C−H など)のうち、このp 軌道と平行になるシグマ結合が超共役に関与する。
(解答例)
6.18
A から遷移状態 B を経由して C に至るとき、図 6.13 にも示されるように吸エルゴン的な反応では遷移状態は生成物に近く、発エルゴン的な反応では遷移状態は出発物に近い。(グラフの横軸が「反応の推移」を表していることに注意。すなわち、グラフ上で横方向に近い位置にある状態ほど構造も互いに似ていると近似的に考えてよい。)
一般に反応中間体は出発物質や生成物よりもエネルギーが高いから、反応中間体が生じる過程は吸エルゴン的、反応中間体より生成物に至る過程は発エルゴン的であると考えられる。
(解答例)
6.19
生じている過程は文章で書くと次のようになる。これを電子対の移動を表現する矢印で描くこと。
・臭化水素から水素イオンがビニル基のパイ電子に付加し、2級のカルボカチオンを生じる。
・続いて、シクロヘキサンの置換基の根元の3級水素が、結合電子ごと(すなわちヒドリドとして )転位し、結果として3級のカルボカチオンとなる。
・最後に、臭素化物イオンがカルボカチオンに付加する。
(解答例)
6.20
アルカンよりもアルケンの方が優先されるから「多重結合を含む中で一番長い」部分が主鎖となる。二重結合が C2 と C3 の間にある炭素数6のアルケンは、二重結合の位置:2番目の炭素(と3番目の炭素の間)を示す数を母体名(ヘキセン)の前に置き、2-hexene とする。更に、ここに置換基を表す部分を加え、完全な名前とする。
シクロアルケンの場合は、1-cycloalkene に対して置換基の位置を示す番号がなるべく小さくなるように番号を振ることに注意。
(解答例)
(a) 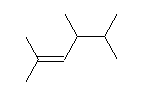
2,4,5-trimethyl-2-hexene
(b) 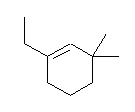
1-ethyl-3,3-dimethylcyclohexene
6.21-6.30
6.21
それぞれ、分子内に二重結合は複数あるが、立体化学(幾何異性体)が区別されるような二重結合はそれぞれ、1箇所ずつであることに注意せよ。
なお、発展でも述べるが、アルデヒドやカルボン酸は、命名上アルケンよりも優先される官能基をなす。
(解答例)
図中、太い線で表した位置の二重結合に対して立体化学が区別できる。複数の二重結合に対して立体化学が区別できるときも、同様の命名に従う。(→発展の項を参照)
(a) 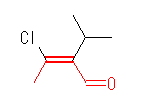
(E)-3-chloro-2-isopropylbutanal
(b) 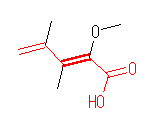
(Z)-2-methoxy-3,4-dimethyl-2,4-pentadienoic acid
次のような構造を持つ場合、カルボン酸を含むことが主鎖を決める上での優先事項になるので、赤で示した部分が主鎖となる。
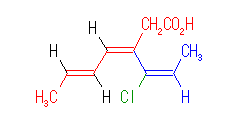
これを命名するときは、次のようになる。
3-[(E)-1-Chloropropenyl]-(3Z,5E)-3,5-heptadienoic acid
6.22
図より、どの位置の炭素上に正電荷が存在するカルボカチオンかを判断する際、炭素からでている結合の数に注目すればよい。
(解答例)
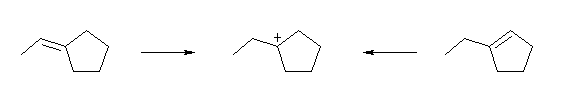
生じたカルボカチオンの正電荷は、もとの二重結合に関与した2つの炭素の一方であったことを考えると、上図のようになる。どちらの場合も、もとの二重結合の炭素上の置換基の数は1と2であり、従って2級および3級のカルボカチオンが生じる可能性のある構造であるが、実際にはどちらから出発した場合でも、3級のカルボカチオンのみが生じると予想できる。
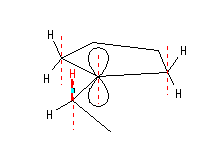
超共役が最大になるのは空のp軌道と平行な方向に結合したC-Hである。
ほとんど平面内にある5員環の炭素からでている C-H 結合は、カルボカチオンの電荷をもつ炭素の空のp軌道と平行になることができない。エチル基は5員環に対して自由に回転することができるので、空のp軌道との超共役が大きい(すなわち安定なカルボカチオンを生じるような)角度をとることができる。
6.23
不飽和度の計算法における、炭素、水素以外の種々の原子の影響は、教科書 p179 にも書かれているように、その原子の持つ結合の数で決まってくる。ただ、このページ全体を理解しようとせずに下部の「要点」の部分のみを暗記しようとするなら、それは間違いのもとになるばかりでなく、おおいに無駄である。
簡単に不飽和度を知るための手段のひとつは、ある程度小さな原子数の分子であれば、その数の炭素を直鎖状にならべて描き、水素、その他の元素を書き加えてみて、実際にいくつ不飽和結合を足せば良いかを確認してみることである。(この作業を、上記「要点」を意識しながら行えば、その意味が理解でき、構造式を書いてみなくても不飽和度が計算できるようになっていくだろう。)
(解答例)
同じ不飽和度でも、可能な構造は、そこに含まれる環構造の数で分類することができる。たとえば不飽和度が2であれば、可能な構造として次の場合がある。
・多重結合を2つ持つ場合。(3重結合が1つ、または2重結合が2つ)
・環の構造を1つと、多重結合を1つ持つ場合。
・環の構造を2つもつ場合。
図で与えた例は、それぞれいくつの環構造と多重結合を含むか、数えて確認すること。
ただし、多重結合は炭素−炭素間のみとは限らない。代表的なそれ以外の多重結合としては、カルボニル( C=O )や、ニトリル( C≡N )などがあり得る。
また、環の員数は3以上の任意であるし、環以外の部分は直鎖状でも分岐していても構わない。つまり、含酸素化合物では、エーテルおよびアルコール、アルデヒド、ケトンなどを考える必要がでてくる。
このため、いくつかの代表的な例のみを示し、"すべての"可能な構造式を与えることはしない。
(a) C10H16 … 不飽和度 = 3 (= [22-16]/2 )
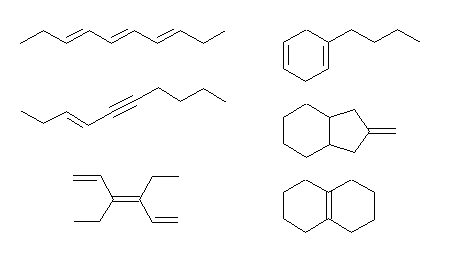
(b) C8H8O … 不飽和度 = 5 (= [18-8]/2 )
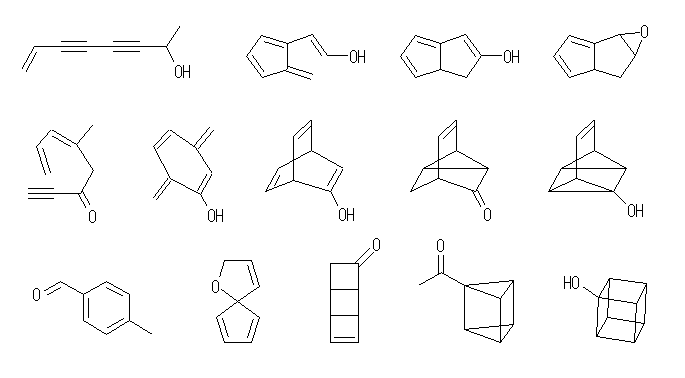
(c) C7H10Cl2 … 不飽和度 = 2 (= [16-(10+2)]/2 )
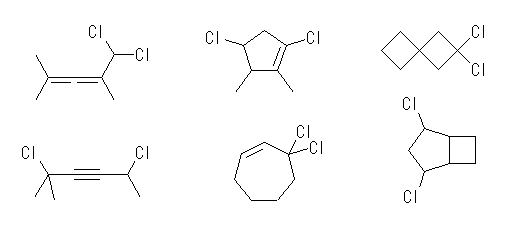
(d) C10H16O2 … 不飽和度 = 3 (= [22-16]/2 )
(e) C5H9NO2 … 不飽和度 = 2 (= [12-(9-1)]/2 )
(f) C8H10ClNO … 不飽和度 = 4 (= [18-(10+1-1)]/2 )
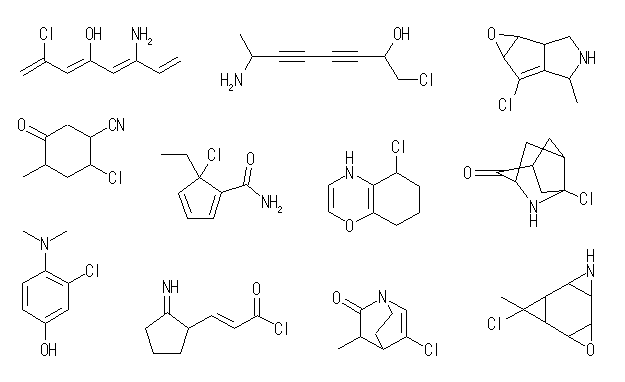
6.24
不飽和度の原因として、環構造と多重結合の存在がある。
・環構造は、接触水素化で水素を吸収しない。
・分子内に「炭素−炭素二重結合」や「炭素−炭素三重結合」がある場合は、同じモル数だけ水素を吸収する。ただし、芳香環(ベンゼン環など)に含まれる二重結合は接触水素化反応で水素を吸収しない。
(解答例)
C10H14 の分子式を持つ分子の不飽和度は、4 (=[22-14]/2)である。接触水素化により、2モルの水素を吸収するから、分子内には二重結合が2つ(または三重結合が1つ)存在し、残りは環構造に由来すると考えられる。
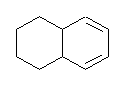
従って、この化合物は上図のように2つの環を持つ。
6.25
(解答例)
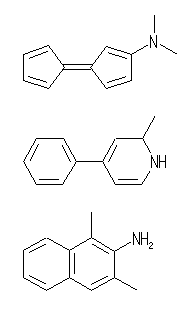 C12H13N の分子式を持つ分子の不飽和度は、7 (=[26-(13-1)]/2)である。この分子が環構造を2つもつならば、多重結合に由来する不飽和度は5である。
C12H13N の分子式を持つ分子の不飽和度は、7 (=[26-(13-1)]/2)である。この分子が環構造を2つもつならば、多重結合に由来する不飽和度は5である。
左図、一番上のように分子内に芳香環が存在しないなら、すべての二重結合は接触水素化により水素1モルずつを吸収するから、5モルの水素を吸収することになる。
中央のように、分子内に芳香環が1つ存在する場合には、接触水素化により吸収する水素は、2モルとなる。
また、下図のように2つの環がともに芳香環となっている場合では、芳香環に属しているもの以外の二重結合がないから、接触水素化で水素を吸収しない。
6.26
教科書 p180 からの命名法を復習すること。立体化学が区別されるような構造式が与えられている場合は、幾何異性体の区別として、E, Z 表記をするようにする。
(解答例)
教科書の記法(多重結合の位置を表す位置番号を母体名の前に置く)に従って命名した。なお、[ ] 内は、IUPAC に厳密に従い、官能基を表す接尾語の直前に位置番号を置いた場合である。(教科書 p180 脚注参照のこと。)
(a) (E )-3-methyl-2-hexene
[ (E )-3-methylhex-2-ene ]
(b) (Z )-4-ethyl-7-methyl-2-octene
[ (Z )-4-ethyl-7-methyloct-2-ene ]
(c) 2-ethyl-1-butene
[ 2-ethylbut-1-ene ]
(d) (E )-3,4-dimethyl-1,5-heptadiene
[ (E )-3,4-dimethylhepta-1,5-diene ]
(e) (2Z, 4E )-4,5-dimethyl-2,4-octadiene
[ (2Z, 4E )-4,5-dimethylocta-2,4-diene ]
(f) 1,2-butadiene
[ buta-1,2-diene ]
(c) は、"多重結合を含む中で"一番長い部分を主鎖にとるから、3-methylidenepentane ではない。
(d) は、(置換基の位置よりも優先して)二重結合の位置番号が小さくなるように番号を振ることに注意する。
(e) 2つの二重結合の立体化学を表す場合は、6.21の(発展)を参照すること。
(f) このように連続した二重結合は、重積二重結合とよばれる。間の炭素は sp 混成で、結合角は180度である。
6.27
(解答例)
(3E )-3,7-dimethyl-1,3,6-octatriene
[ (3E )-3,7-dimethylocta-1,3,6-triene ]
教科書に与えられているのは、β-ocimene ( Me2C=CHCH2CH=CMeCH=CH2 )である。
α-ocimene は CH2=CMeCH2CH2CH=CMeCH=CH2 の構造をもつ。
β-オシメンは、植物の害虫に対する誘導防衛に関与する物質として知られている。
詳細は、ここ(外部へリンクします。 などを参照のこと。
6.28
(解答例)
(3E, 6E )-3,7,11-trimethyl-1,3,6,10-dodecatetraene
[ (3E, 6E )-3,7,11-trimethyldodeca-1,3,6,10-tetraene ]
6.29
(解答例)
上段左より (a) 〜 (c)、下段左より (d) 〜 (f)
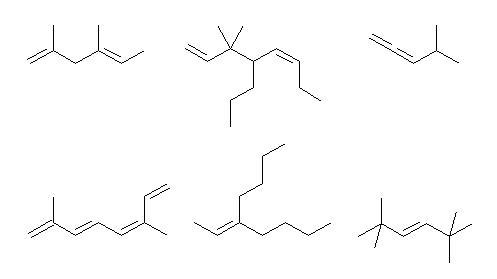
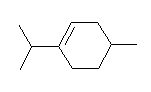
6.30
(解答例)
6.31-6.40
6.31
・主鎖が hexene となるもの
→ hexane の異なる位置に二重結合を置く。( 1-hexene, 2-hexene )
そのそれぞれについて、幾何異性体が存在しないかチェックする。
・主鎖が pentene となるもの
→ pentane の異なる位置に二重結合を置く。( 1-pentene, 2-pentene )
→ 上のそれぞれに、異なる位置に methyl 基を置換させる。( 2-methyl-1-pentene, 3-methyl-1-pentene, 2-methyl-2-pentene )
そのそれぞれについて、幾何異性体が存在しないかチェックする。
(解答例)
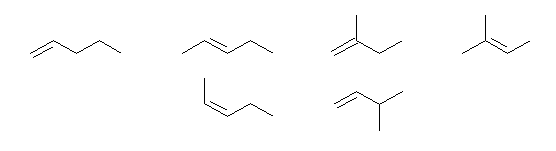
それぞれの構造に対応する命名については、ヒントを参照のこと。
6.32
アルカンで骨格異性体を探したときには、C2 の位置にはエチル基など炭素数の大きな置換基を置けなかった(主鎖が一番長くなければいけないから)のに対し、1-alkene の場合では、2位に長い置換基がくる場合があることに注意する。
(解答例)
赤で示した構造は、幾何異性体をもつ。(ここでは一方のみを示している。そのため、問題に指定してある17種のうち、13種のみを示す。)
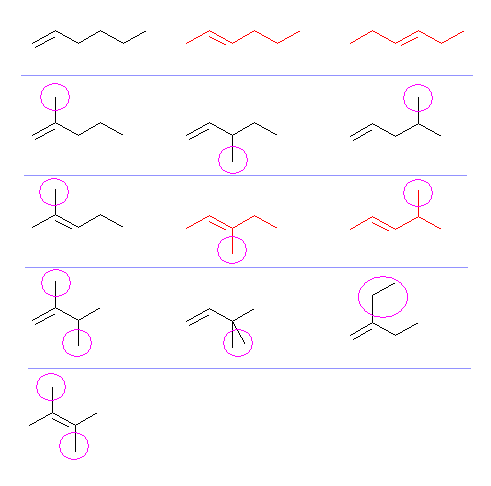
上段左より順に
1-hexene, (E)-2-hexene, (E)-3-hexene
2-methyl-1-pentene, 3-methyl-1-pentene, 4-methyl-1-pentene
2-methyl-2-pentene, (E)-3-methyl-2-pentene, (E)-4-methyl-2-pentene
2,3-dimethyl-1-butene, 3,3-dimethyl-1-butene, 2-ethyl-1-butene
2,3-dimethyl-2-butene,
6.33
2-butene の Z 体が、E 体よりも不安定な理由については、教科書 p189 を参照せよ。これを、2,2,5,5-tetramethyl-3-hexene に適用したときにどうなるか。
(解答例)
(Z)-2-butene, (Z)-2,2,5,5-tetramethyl-3-hexene の構造を次に示す。
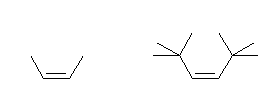
上図よりわかるように、メチル基同士の立体反発に由来する 2-butene の Z 体における E 体に比較しての不安定さよりも、t-ブチル基同士の立体反発に由来する 2,2,5,5-tetramethyl-3-hexene の Z 体における E 体に比較しての不安定さの方が大きい。
6.34
教科書に、「分子モデルを組むと参考になる」のヒントが与えられているように、「分子モデルを組むことができない」、「(適当な結合角と結合長で)分子の構造を描くことができない」ような分子は、結合角などのひずみが大きいためなどの理由により不安定であると考えられる。
(解答例)
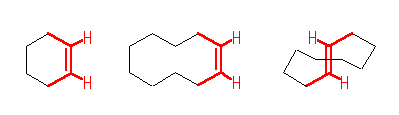
上図、赤で示した5本の結合は、(ほぼ)同一平面内にある。員数のおおきなシクロアルケンは、上図のシクロデセンの構造式のように、Z 体、E 体ともにとることが可能であるが、員数の小さなシクロヘキセンは、Z 体しかとることができない。
問い 6.35, 6.36 にも関連して、シクロオクテン、シクロノネンにおいても Z 体以外に、E 体をとることも可能であるが、これらのシクロアルケンにおいては E 体の方が不安定であり、その度合いは環の員数が小さいほど大きくなる。これは、E 体においては、図に赤で示されたような二重結合とその上の置換基の根元の原子をすべて同一平面内に置こうとしたときに、環の員数が小さいときには長さが足りず、歪むからであると考えられる。
6.35
(解答例)
6.34 のヒントと解説を参照すること。
6.36
(解答例)
6.34 のヒントと解説を参照すること。
6.37
(解答例)
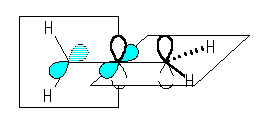
中央の炭素は、sp 混成をしており、上図のような p 軌道をもつ。
sp 混成の炭素の結合角は 180 度である。従って、アレンは3つの炭素が直線状に並んでおり、また、4つの水素は直交した2つの面の上にある。
6.38
すなわち、同じ生成物を与えるような二つの反応では、負でより絶対値の大きな反応エネルギーをもつものでの出発物質の方が不安定である。
(解答例)
たとえば同じ pentane を与えるような水素化反応2つを考える。
出発物質は、一方は重積二重結合をもつアレン類(下図左 1,2-pentadiene)、もう一方は重積ではない二重結合を2つもつジエン類(下図右、1,4-pentadiene)であるものとする。
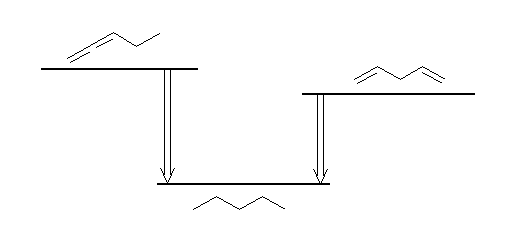
左は、アレンの水素化熱は置換基に依ってはさほど変化しないと仮定して、298 kJ/mol の発熱反応であり、また右は、プロペンの水素化熱を2倍して求められるように、252 kJ/mol の発熱反応となる。すなわち、アレンはジエンよりも一般に不安定である。
6.39
(解答例)
(a) 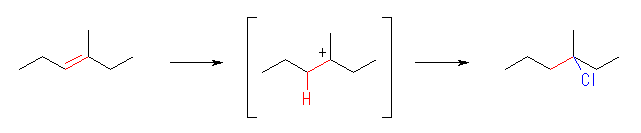
3-chloro-3-methylhexane
(b) 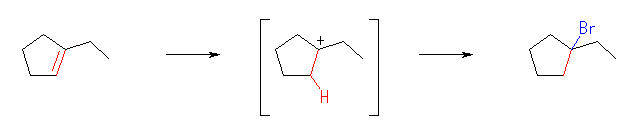
1-bromo-1-ethylcyclopentane
(c) 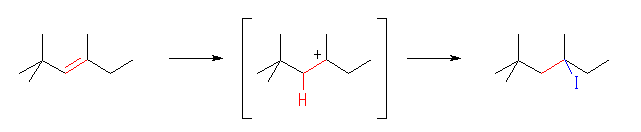
4-iodo-2,2,4-trimethylhexane
(d) 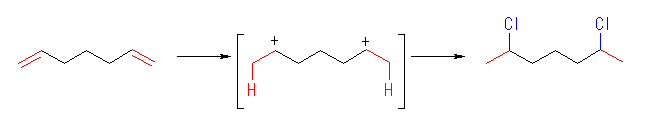
この反応は、上のようなジカチオンを経由すると考えるより、まず塩化水素が1モル付加して 6-chloro-1-heptane を生じ、つづいて2モルめの塩化水素が付加すると考えた方が自然である。
2,6-dichloroheptane
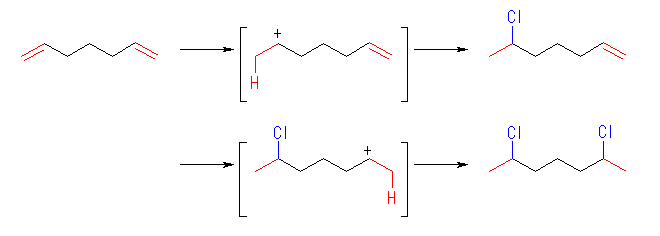
(e) 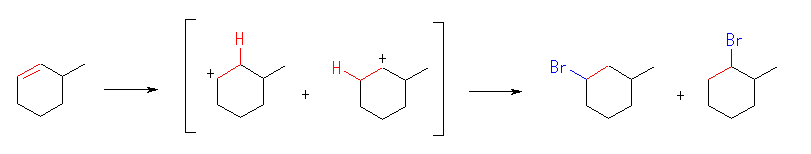
生じるカルボカチオンは、どちらも2級で安定性に大きな差はない。このため、2種類の生成物はほぼ等しい量生じると予想される。
1-bromo-3-methylcyclohexane, 1-bromo-2-methylcyclohexane
Q: (e)ではヒドリド移動が起きて、3級の一つの生成物に限定できるのではありませんか?
A: ヒドリド移動が起きるか起きないかは、カルボカチオンでいる時間が長いか短いかなど、 さまざまな要因に依ると思います。カルボカチオンの転移は、常におきる可能性がありま すので、生成物が「予想通り」にならないこともよくあります。
なお、今回の質問では、はじめにできるカルボカチオンは、両方とも2級ですから、ほぼ 同じ量のカルボカチオンが生じるでしょう。カルボカチオンの場合は、ブロモニウムイオ ンなどの3員環のものではないので、2つは区別されると考えられます。このうち、3級 炭素に隣接したものの方は、ヒドリド移動により3級のカルボカチオンに転移することが 予想できますが、仮にこの転移が100%起きたとしても、はじめに生じる2級のカルボ カチオンのもう一方の方からは、2つ離れた位置までのヒドリド移動は、遠いため、あま り起きないだろうと仮定するならば、生成物はひとつにはなりません。
とはいえ、生成物が一つになってしまう可能性がないわけではありません。そのような説 明も可能です。アルケンに対してプロトンが付加しカルボカチオンを与える過程は、実は 可逆です。つまり、カルボカチオンからプロトンが脱離すると(臭化アルカンからの臭化 水素の脱離の過程と似ていますが)アルケンを与えますね。問題で与えられている 3-メ チルシクロヘキセンにプロトンが付加し、またプロトンが脱離する過程をくり返している うちに、一番安定なアルケンである 1-メチルシクロヘキセンになってしまいます。(3- メチルシクロヘキセンの1位にプロトンが付加し、2位に正電荷のあるカルボカチオンに なったのち、3位からプロトンが抜ける。生じたアルケンは多置換であるほど安定であ る。)
このメカニズムが成り立つためには、臭化物イオンによる攻撃が遅くないといけませ ん。(通常、酸性条件下では、臭化アルカンから2級のカルボカチオンができる過程は、 それほど速いとは考えませんので。)しかし、このメカニズムが成り立ちさえすれば、ヒ ドリド移動の説明をせずに 1-ブロモ-1-メチルシクロヘキサンが主生成物となることの説 明もできてしまいます。
今の教科書のレベルでは、あまり入り組んだところまでの説明は求められていませんか ら、大学編入試験レベルくらいまでは、まずはヒドリドの転移等を考えなくて説明できる 通常の生成物はなにかというところを押さえておいて、その上で、「予想される生成物と は異なるものができてしまった時に、その理由を」尋ねられたときに説明できるようにし ておく、というところで良いと思います。
6.40
(解答例)
(a) 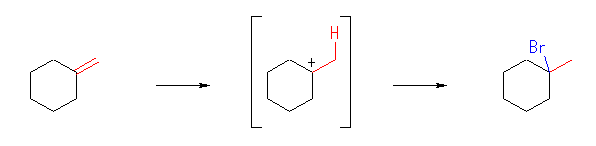
1-bromo-1-methylcyclohexane
(b) 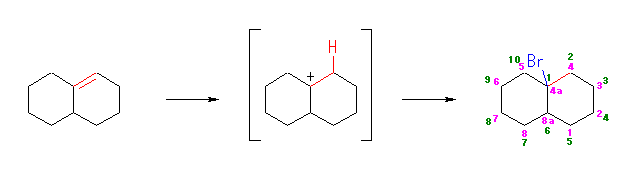
1-bromobicyclo-[4.4.0]-decane,
or 4a-bromo-1,2,3,4,4a,5,6,7,8,8a-decahydronaphthalene
ことなる体系の命名法で、位置番号が異なることに注意する。
(c) 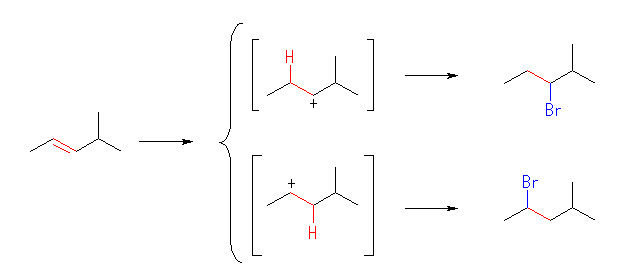
3-bromo-2-methylpentane, 2-bromo-4-methylpentane
6.41-6.50
6.41
・多重結合を含む置換基は次のように開く。(シグマ結合の順を変えない。多重結合ではその両側の原子に単結合が二重、三重にあるものとする。ただし、この時重複する原子(下図、カッコ付き赤文字で表した)は、その先には結合を考えない。)
たとえば、アルデヒド基の根元の炭素からは、-O-(C)、-(O)、-H が結合していると考える。
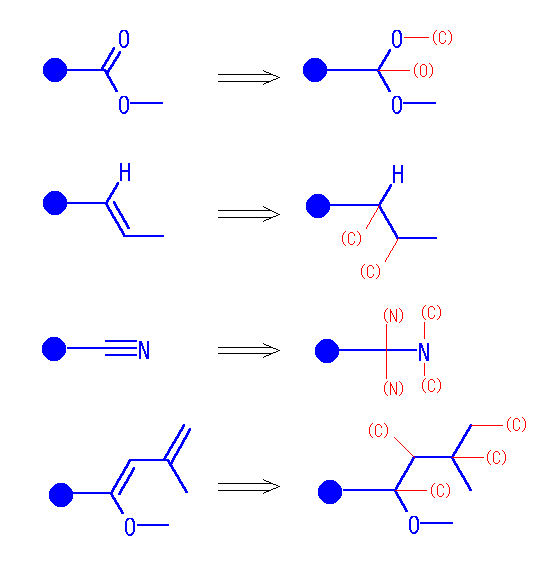
・根元から1番目の原子、根元から2番目の原子、3番目の原子… とグループ分けしてならべる。同じ順位のものは、同じ原子に結合しているものごとにまとめながら、重いものほど前にならべておく。
-CH2OH なら -C-{O, H, H}-[H]、アルデヒド基 -C(=O)H なら -C-{O, O, H}-[C] となる。
・根元から近いところから、同順の場合は重いものから軽いものへの順で差が現れるまで、比較する。
-C-{O, H, H}-[H] < -C-{O, O, H}-[C]
同じ距離の原子、たとえば2番目の原子の種類と数の構成が同じである場合は、その中で一番重い原子について3番目以下の原子の結合をみて順位に差をつける。
(例):-C(S-CH3)OH と、-C(O-SiH3)SH の場合。
1番目の原子:どちらも C で同順。
2番目の原子:どちらも S, O, H の3つ。やはり同順。
3番目の原子を参考に2番目の原子に差をつける:まず、2番目の原子のうち一番重い S についている原子に注目する。前者では[C]、後者では[H]だから、Sの方が優先順位が上となる。(どの原子から結合しているかを無視すれば、[C, H]、[Si, H] となり、後者の方が重いように見えるが、これは間違い。)
-C-{S[C], O, H} > -C-{S[H], O, H}
(解答例)
原子番号の大きい順。同じ原子については、次の原子で判断する。(判断した位置を下線で表記した。)
(a) -I > -Br > -CH3 > -H
(b) -OCH3 > -OH > -COOH > -H
(c) -CO2CH3 (-C-{O[CH3], O[(C)], (O)}) > -CO2H (-C-{O[(C)], O[H], (O)}) > -CH2OH (-C-{O, H, H}) > -CH3 (-C-{H, H, H})
2番目の原子として{O, O, O}×2通り > {O, H, H} > {H, H, H} としたのち、2つの{O, O, O}については3番目の原子以降(カッコ [ ] で表現した)を考慮した。カッコ ( ) は、多重結合を開いてその先の結合を考えない原子を表している。
(d) -C(=O)CH3 (-C-{O, O, C}) > -CH2CH2OH (-C-{C[O, H, H], H, H}) > -CH2CH3 (-C-{C[H, H, H], H, H}) > -CH3 (-C-{H, H, H})
(e) -CH2Br (-C-{Br, H, H}) > -CN (-C-{N, N, N}) > -CH2NH2 (-C-{N, H, H}) > -CH=CH2 (-C-{C, C, H})
(f) -CH2OCH3 (-C-{O[C], H, H}) > -CH2OH > (-C-{O[H], H, H}) > -CH=CH2 (-C-{C, C, H}) > -CH2CH3 (-C-{C, H, H})
6.42
ただし、これらの化合物は、6.11 同様に、いずれも命名上アルケンよりも優先度の高い官能基を含んでいる。
(解答例)
立体配置も含めたこれらの化合物の命名は次の通り。
(a) (Z)-2-methyl-2-butene-1-ol
(b) (Z)-2-chloro-3-methoxy-2-propenoic acid
(c) (E)-2-ethyl-4-hydroxy-3-methyl-2-butenenitrile
(d) 2-[1-ethyl-2-propen-(Z)-ylidene]malonic acid monomethyl ester
6.43
シクロアルケンの番号の付け方に注意する。多重結合が1,2位になるのが最優先、2つ目以降の多重結合がある場合は、その番号が小さくなるようにする。次いで置換基の番号が小さくなるように考える。
(解答例)
(a) 3-methylcyclohexene
(b) 2,3-dimethylcyclopentene
(c) 1-ethyl-1,3-cyclobutadiene
(d) 1,2-dimethyl-1,4-cyclohexadiene
(e) 5-methyl-1,3-cyclohexadiene
(f) 1,5-cyclooctadiene
6.44
(解答例)
(a) 正しい
(b) 正しい:CH2-CH=CH2 と CH2-CH(CH3)2 を比べると、2番目の炭素から結合しているものはともにC, C, H であるが、その下位の原子を数えると {C[(C)], C[H2], H} および {C[H3], C[H3], H} となるから、2-propenyl基の方が順位が高い。
(c) 誤り:-CH2NH2 と -CH2NHCH3 を比べると、2番目の窒素から結合しているものが {H, H} および {C, H} なので後者の方が順位が高い。
(d) 正しい:-CN は -C-{N[(C), (C)], (N), (N)} と多重結合を開くことができる。-CH2N(CH3)2 は、-C-{N, H, H} だから、炭素に結合した原子の種類だけで順位が決まる。
(e) 誤り:cyclopentylidene 基は左右対称なので、幾何異性体は存在しない。
(f) 正しい:-CO2H は -C-{O[(C), O[H], (O)]} と開くことができ、-C(=O)CH3 ( -C-{O[(C)], (O), C[H3]} ) より順位が高い。
6.45
(解答例)
tert-ブチルエステルは、メチルエステルよりも順位が上であるが、加水分解して生じるカルボキシル基はメチルエステルよりも順位が下となる。このため、二重結合のまわりの立体が入れ替わるのではなく、単に命名のルール上で、E, Z の表記が入れ替わるだけである。
6.46
二重結合に対するハロゲン化水素の付加反応では、出発原料の二重結合のうち π 結合のみが切れて、代わりに C-H 結合および C-X ( X はハロゲン)結合ができる。π 結合のみの結合解離エネルギーは、近似的に、二重結合と単結合の結合解離エネルギーの差として求めることができる。
(解答例)
π 結合のみの結合解離エネルギーは、表5.3 の二重結合と単結合の結合解離エネルギーより、235 ( = 611 - 376 ) kJ/mol である。従って、エテンへの
HCl の付加反応では、π 結合が切れ、代わりに C-H 結合および C-Cl 結合ができるから
ΔHo = -536 ( = 235 - ( 420 + 351 )) kJ/mol
HBr の付加反応では、同様に
ΔHo = -478 ( = 235 - ( 420 + 293 )) kJ/mol
HI の付加反応では、同様に
ΔHo = -419 ( = 235 - ( 420 + 234 )) kJ/mol
最も発熱的である反応は、HCl の付加反応であり、これが最もおこりやすいと考えられる。
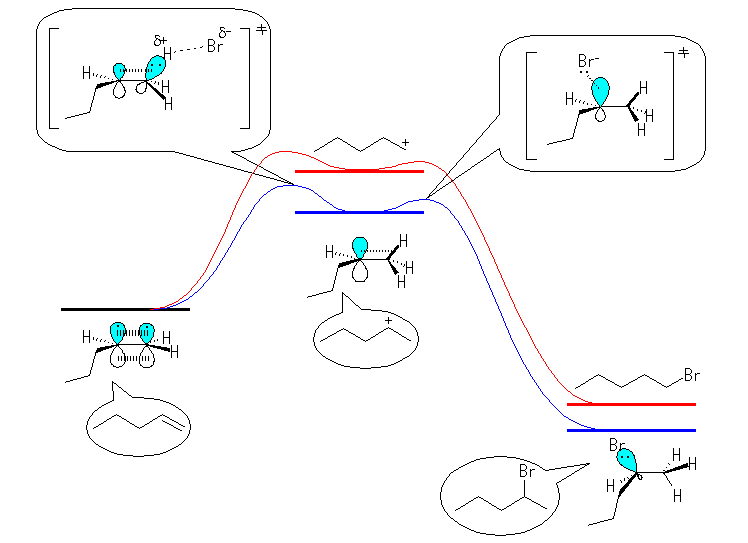
反応の起こりやすさは、出発原料と生成物の間の平衡、すなわち反応自由エネルギー変化で決まる部分と、反応の速さ、すなわち活性化エネルギーで決まる部分に分けて考える必要がある。Hammond の仮説によれば、反応の自由エネルギー差が大きくより発熱的になればなるほど、活性化エネルギーも小さくなる。すなわち、一般に平衡が生成物に有利にずれる反応ほど、反応にかかる時間も短い。
アルケンに対するハロゲン化水素の付加反応は、中間体としてプロトンの付加により生じたカルボカチオンを経由すると考えられており、その構造はハロゲンの種類に依らず一定であるとされている。また、問題 6.18 でみたように、中間体に至るまでの遷移状態や、中間体から生成物に至る過程で通る遷移状態は、中間体カルボカチオンと近い構造やエネルギーを持つと考えられる。すなわちこれを考慮すると、反応の速さは、ハロゲンの種類に依らずほぼ同じという結論に至る考え方もある。
ただし、中間体として考えているカルボカチオンは共通であるように見えても、そのエネルギーを考える際には、実際にはカルボカチオンの近傍に対となる陰イオンとしてハロゲン化物イオンも存在しており、これによるエネルギーの変化も当然考慮に入れなければならない。これにより、共通の構造をもつ中間体を経由する場合でも、反応速度に差がでることもあり得る。
6.47
・正に帯電した炭素の、隣接炭素の上から、
・水素(-H)、メチル(-CH3)、フェニル(-C6H5)基、またはアルキル基が、
・共有結合の電子を対として持ったまま移動して、
・2級や3級の安定なカルボカチオンを生じる。
(解答例)
(a) 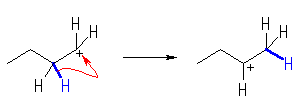
のように、2級カルボカチオンに転位する。
3級カルボカチオンは、次図のように更に2回の転位を経ないと生じないが、途中で、より安定性が低く2級のカルボカチオンからの転位が生じにくい1級のカルボカチオンを経由しないといけないので、考えなくてよい。(絶対に生じないという保障はない。実験の条件によって変わる可能性は残されている。)
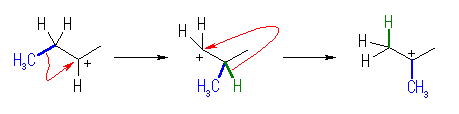
(b) もとの2級カルボカチオンよりも安定な3級のカルボカチオンが生じるような転位のみを考える。
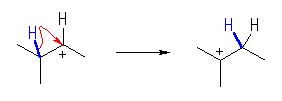
(c) 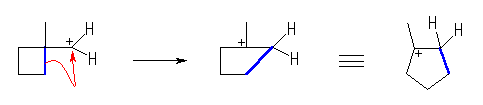
6.48
(解答例)
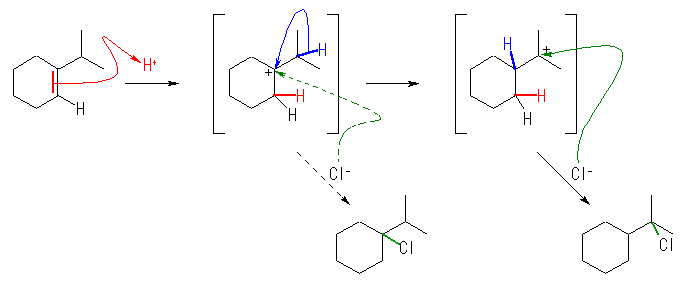
はじめに生じたカルボカチオンと塩化物イオンが反応すると通常の生成物として、1-chloro-1-isopropylcyclohexane が得られるが、カルボカチオンが、更に転位してから塩化物イオンと反応すると、1-(1-chloro-1-methylethyl)cyclohexane を生じる。
6.49
(解答例)
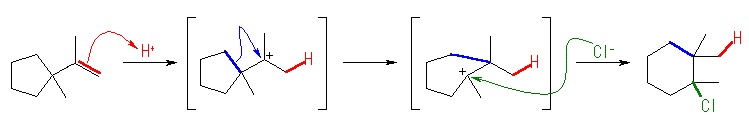
教科書の問いに示された図では、生成物の構造が上下逆に示されている。
6.50
(解答例)
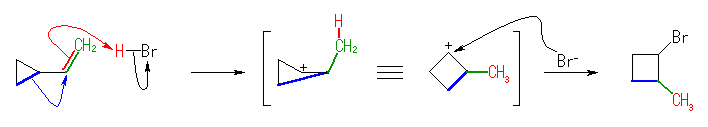
2-メチル-1-シクロブチルカチオンを経由して、1-ブロモ-2-メチルシクロブタンを生じる。
6.51-6.57
6.51
(解答例)
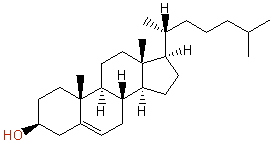
(a) Cholesterol, コレステロール, C27H46O :不飽和度 = 5 (= ( 56 - 46 )/2 )
次図のように、4つの環構造と1つの二重結合をもつ化合物である。
IUPAC名 : cholest-5-en-3β-ol
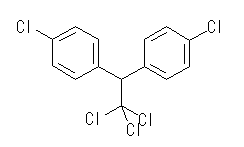
(b) DDT (Dichloro-Diphenyl-Trichloroethane), C14H9Cl5 :不飽和度 = 8 (= ( 30 - ( 9 + 5 ))/2 )
次図のように2つの芳香環(環2つと二重結合6つ)をもつ化合物である。
IUPAC名 : 1,1,1-trichloro-2,2-bis(p-chlorophenyl)ethane
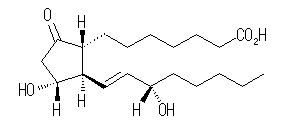
(c) プロスタグランジンE1, PGE1, C20H34O5 :不飽和度 = 4 (= ( 42 - 34 )/2 )
次図のように環構造1つの他、炭素−炭素二重結合1つ、カルボニル(カルボン酸中のものを含む)2つをもつ化合物である。
IUPAC名 : (1R,2R,3R)-3-hydroxy-2-[(E)-(3S)-3-hydroxy-1-octenyl]-5-oxocyclopentaneheptanoic acid
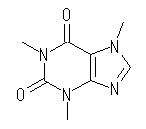
(d) カフェイン, Caffeine, C8H10N4O2 :不飽和度 = 6 (= ( 18 - ( 10 - 4 ))/2 )
IUPAC名 :3,7-Dihydro-1,3,7-trimethyl-1H-purine-2,6-dione
次図のように環構造2つ、二重結合4つ(カルボニル等を含む)をもつ化合物である。
(e) コルチゾン, Cortisone, C21H28O5 :不飽和度 = 8 (= ( 44 - 28 )/2 )
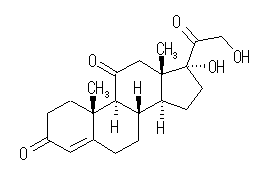
IUPAC名 :17,21-dihydroxypregn-4-ene-3,11,20-trione
次図のように環構造4つ、炭素−炭素二重結合1つと3つのカルボニル基をもつ化合物である。
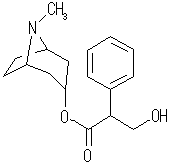
(f) アトロピン, atropine, C17H23NO3 :不飽和度 = 7 (= ( 36 - ( 23 - 1 ))/2 )
IUPAC名 :tropan-3α-yl rac-3-hydroxy-2-phenylpropanoate
次図のように3つの環構造、4つの多重結合をもつ化合物である。
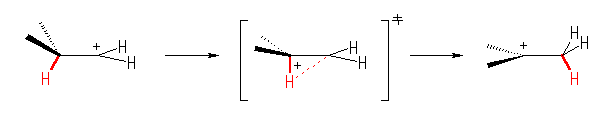
6.52
・カルボカチオンが1級から3級になっていること。
・反応が自発的におきていること。
(解答例)
カルボカチオンは、1級から3級になる。自発的に反応がおこることからも、より安定な生成物を与える反応で、発エルゴン的であるということがわかる。
Hammond の仮説より、発エルゴン的な反応なので、遷移状態は出発物に近いと考えられる。
6.53
(解答例)
1級より2級のカルボカチオンの方が安定であるから、エネルギー図において、下方に描く。
6.54
(解答例)
6.53 を参照
6.55
(解答例)
この反応では、1-chloropropane から生じた1級のカルボカチオンは、ヒドリド転位により2級のカルボカチオンに転位してからベンゼンと反応するため、主生成物としてイソプロピルベンゼンを与える。
6.56
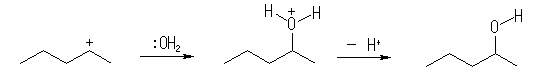
(解答例)
いずれも構造から考えられるカルボカチオンが、1級と2級、2級と3級のように安定性に差があるため、一方しか生じない。このため、主生成物もそれぞれ1つである。
(a) 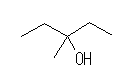
3-methylpenan-3-ol
(b) 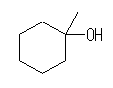
1-methylcyclohexan-1-ol
(c) 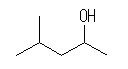
4-methylpenan-2-ol
6.57
(解答例)
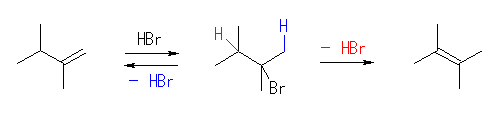
反応機構については、11章で学ぶ。