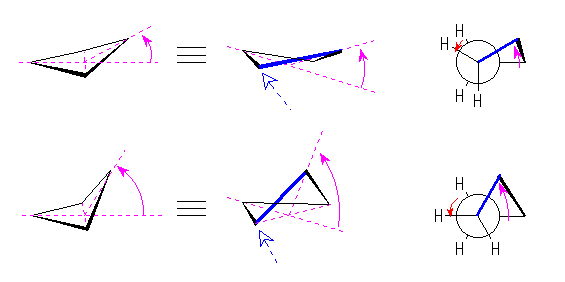
4.01-4.10
4.01
1) プロパンの C1−C2 結合軸に沿ってみたときの Newman 投影図を、任意の重なり形、またはねじれ型の立体配座に対して書く。プロパンは、 H3C1-C2H2-CH3 だから、C1 からは3つの水素が、C2 からは2つの水素と1つのメチル基が結合している。
2) C1−C2 結合軸に沿って60度ごとに1回転(0度から360度まで)させ、それぞれの立体配座に対応する Newman 投影式を書く。
3) それぞれの点におけるエネルギーを求める。
ねじれ形に対しては、特に相互作用がないので、0とする。重なり形の相互作用に関しては、教科書 109 ページの図4.4 を参考とし、水素−水素の重なり1組に対して 4.0 kJ/mol、水素−メチル基の重なり1組に対して 6.0 kJ/mol と考える。
4) グラフの横軸に、回転角(任意の点を0度としてよい)を、縦軸にはそれぞれの立体配座に対するエネルギーをプロットする。
5) これらの点をなめらかに結ぶ。
(解答例)
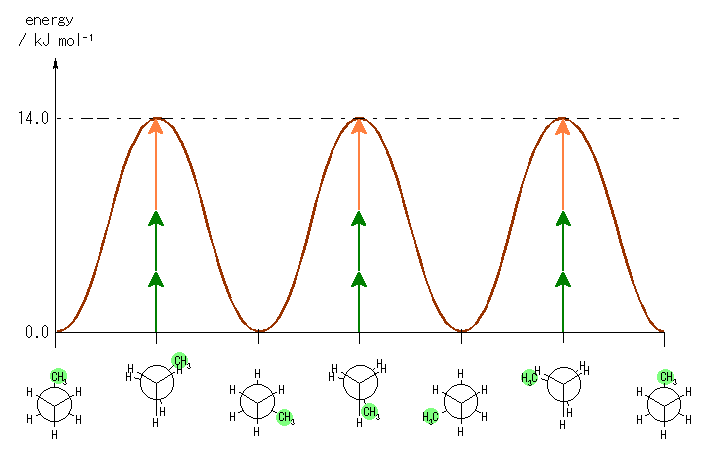
4.02
ブロモエタンは、H3C1-C2H2-Br だから、C1 からは3つの水素が、C2 からは2つの水素と1つの臭素が結合しており、プロパンの末端のメチル基を臭素に置き換えたと考えてもよい。4.01 の答えも参考に考えることが可能である。
最も安定な配座は、ねじれ形配座の中のひとつ。もっとも不安定な配座は、重なり形配座の中のひとつ。
(解答例)
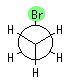
 左が最も安定な配座、右が最も不安定な配座(の中のひとつ。)
左が最も安定な配座、右が最も不安定な配座(の中のひとつ。)
4.03
1) 2-メチルプロパンの C1−C2 結合軸に沿ってみたときの Newman 投影図を、任意の重なり形、またはねじれ型の立体配座に対して書く。
C1 からは3つの水素が、C2 からは1つの水素と2つのメチル基が結合している。
2) C1−C2 結合軸に沿って60度ごとに1回転(0度から360度まで)させ、それぞれの立体配座に対応する Newman 投影式を書く。
3) それぞれの点におけるエネルギーを求める。ここで計算する結果が、(d) のこたえとなる。
ねじれ形に対しては、特に相互作用がないので、0とする。重なり形の相互作用に関しては、教科書 109 ページの図4.4 を参考とし、水素−水素の重なり1組に対して 4.0 kJ/mol、水素−メチル基の重なり1組に対して 6.0 kJ/mol と考える。
4) 以上の結果をもとに、(a) 最も安定な、(b) 最も不安定な 立体配座を決める。 5) (c) グラフの横軸に、回転角(任意の点を0度としてよい)を、縦軸にはそれぞれの立体配座に対するエネルギーをプロットし、これらの点をなめらかに結ぶ。
(解答例)
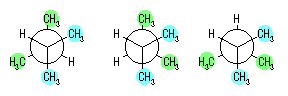
(a) 最も安定な配座は、ねじれ形配座の中のひとつである。2-メチルプロパンでは、回転角をかえて書いたねじれ形配座は次の3つとなるが、このエネルギーはいずれも等しい。
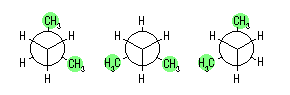
(b) 最も不安定な配座は、重なり形配座の中のひとつである。2-メチルプロパンでは、回転角をかえて書いた重なり形配座は次の3つとなるが、このエネルギーはいずれも等しい。
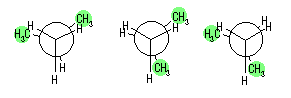
(c)(d) グラフの概形および、その極大、極小点のエネルギーの相対値は次のグラフの通り。
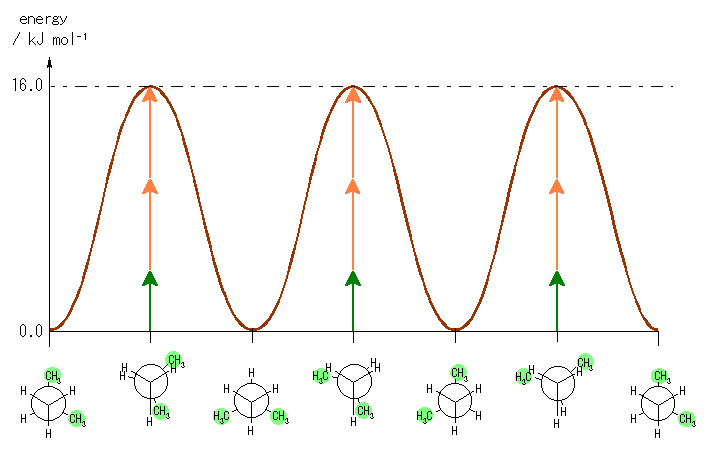
4.04
1) 2,3-ジメチルプロパンの C2−C3 結合軸に沿ってみたときの Newman 投影図を、任意の重なり形、またはねじれ型の立体配座に対して書く。
C2 からは1つの水素と2つのメチル基が、C3 からも1つの水素と2つのメチル基が結合している。
2) C2−C3 結合軸に沿って60度ごとに1回転(0度から360度まで)させ、それぞれの立体配座に対応する Newman 投影式を書く。
3) それぞれの点におけるエネルギーを求める。
4.01、4.02 では見られなかった相互作用として、ねじれ形に対しても、2つのメチル基が Gauche 形になっているときの相互作用(教科書 111 ページより、1組のメチル基に対して 3.8 kJ/mol )を考える必要がある。
重なり形の相互作用に関しては、教科書 109 ページの図4.4 を参考とし、水素−水素の重なり1組に対して 4.0 kJ/mol、水素−メチル基の重なり1組に対して 6.0 kJ/mol と考える。
4) 以上の結果をもとに、(a) 最も安定な、(b) 最も不安定な 立体配座を決める。
(解答例)
(a) 最も安定な配座は、ねじれ形配座の中のひとつである。2,3-ジメチルプロパンでは、回転角をかえて書いたねじれ形配座は次の3つとなる。
左のものでは、Gauche 相互作用が2箇所、中央および右のものでは、Gauche 相互作用が3箇所存在する。従って、左のものが一番安定な配座である。
(b) 最も不安定な配座は、重なり形配座の中のひとつである。2,3-ジメチルプロパンでは、回転角をかえて書いた重なり形配座は次の3つとなる。
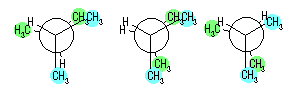
中央のものは、2組のメチル−メチルの重なり相互作用(11.0 kJ/mol)と、水素−水素の重なり相互作用(4.0 kJ/mol)を持つ。左右の2つは、1組のメチル−メチルの重なり相互作用と、2組の水素−メチルの重なり相互作用(6.0 kJ/mol)をもつ。
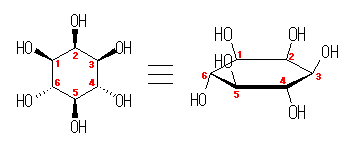
以上を考慮すると、中央のものが一番不安定な立体配座である。
4.05
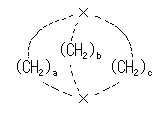
C2、C3 ともに1つの水素と2つのメチル基が結合している。
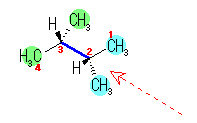
図を見ながら、この回転角に対応した立体配座の Newman 投影式を書く。たとえば、上図の 2,3-ジメチルブタンを構成する炭素のうち、紙面内にある炭素( C1 〜 C4 と番号を振ったもの)を、垂直な線上に配置すると、紙面より手前にでている2つの水素は垂直な線の左側に、また紙面より奥にある2つのメチル基は垂直な線の右側に、それぞれ描くこととなる。
(解答例)
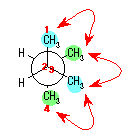
上図のようになり、3組のメチル−メチルの Gauche 相互作用によるひずみエネルギーがあるから、全ひずみエネルギーは、
3.8 kJ/mol × 3 = 11.4 kJ/mol
である。
4.06
まずは、図4.8 のひずみエネルギーをどのようにして求めたものかを復習してみよう。(図のキャプションを精読すること。)
図4.8 のキャプションを、別の表現をしておこう。ここで、燃焼熱(燃焼に伴う発熱)は −ΔHcom の記号で表すものとする。(物理化学でいうところの燃焼熱(燃焼エンタルピー) ΔHcom は、系の内部のエネルギー変化に注目した値であるから、燃焼反応にともなう(系外への)発熱量は、この値の符号を替えたものである。)
シクロプロパンのひずみエネルギーは、次の計算式によって与えられる。
[−ΔHcom(cyclopropane, cyclic-(CH2)3 )] − [−ΔHcom(trimethylene, straight-(CH2)3 )]
ただし、straight-(CH2)3 とは、メチレン(-CH2-)が3つからなる仮想的な直線分子、「-CH2-CH2-CH2-」のことである。なお、この燃焼熱は、
[−ΔHcom(methylene, straight-(-CH2-) )] × 3
で与えられる。(教科書 114 ページ記述:「炭化水素の燃焼熱はその分子の大きさに依存する…」)
−ΔHcom(methylene, straight-(-CH2-) ) は、実測値はともかく、理論的には、メタンとエタンの燃焼熱の差であり、また、エタンとプロパンの燃焼熱の差、プロパンとブタンの燃焼熱の差である。
(解答例)
シクロヘキサン (cyclic-(CH2)6) は、シクロプロパン (cyclic-(CH2)3) に対して分子量が倍であるから、同じ重さ当たりではシクロプロパンはシクロヘキサンの2倍の物質量(モル数)を含む。
シクロヘキサン1モルを燃焼させたとき、ひずみエネルギーが0であるから、その反応熱は、
−ΔHcom(hexamethylene, straight-(CH2)6 )
に等しい。一方、シクロプロパン2モルを燃焼させたとき、その反応熱は、
2 × [−ΔHcom(cyclopropane, cyclic-(CH2)3 )]
= 2 × ( [−ΔHcom(trimethylene, straight-(CH2)3 )] + E環ひずみ )
に等しく、環ひずみエネルギー E環ひずみ は 115 kJ/mol である。
[−ΔHcom(trimethylene, straight-(CH2)3 )] × 2 = [−ΔHcom(hexamethylene, straight-(CH2)6 )]
であるから、1モルのシクロヘキサンと2モルのシクロプロパンの燃焼熱の差は、次式で表される。
[−ΔHcom(cyclohexane, cyclic-(CH2)6 )] − 2 × [−ΔHcom(cyclopropane, cyclic-(CH2)3 )]
= 2 × E環ひずみ(cyclopropane) = 230 kJ
つまり、環ひずみのないシクロヘキサンを燃焼させたよりも、環ひずみの大きいシクロプロパンを燃焼させたときの方が(環ひずみエネルギーの分だけ)発熱量が多い。このため、燃料としては、シクロプロパンの方が効率が良いと言える。
種々の有機化合物の燃焼熱の実測データは、「アトキンス 物理化学」などの教科書に求めることができる。その値をいくつか抜粋しておく。
| hydrocarbons | −ΔHcom / kJ mol-1 |
|---|---|
| methane, CH4, (g) | 890 |
| ethane, C2H6, (g) | 1560 |
| propane, C3H8, (g) | 2220 |
| butane, C4H10, (g) | 2878 |
| pentane, C5H12, (g) | 3537 |
| cyclopropane, C3H6, (g) | 2091 |
| cyclohexane, C6H12, (l) | 3920 |
シクロプロパンとプロパンの燃焼を比べたときに、プロパンの場合の燃焼による発熱が大きいのは、生成物の差(プロパンからは二酸化炭素3モルと水4モルが生じ、シクロプロパンからは二酸化炭素3モルと水3モルが生じる。)によるものである。
4.07
(解答例)
シクロプロパン分子中に、水素−水素重なり形の相互作用は6組ある。(ひとつの水素に対し、2つの隣接炭素上の水素と互いに重なり形相互作用するので、環の上で3組、下で3組ある。)
したがって、重なり形相互作用によるひずみエネルギーは、
6 × 4.0 kJ/mol = 24.0 kJ/mol
である。これは、シクロプロパンの全環ひずみ 115 kJ/mol に対して 20.9 % である。残りの79.1 % は、結合角のひずみによるものである。
4.08
cis-1,2-dimethylcyclopropnane 、および trans-1,2-dimethylcyclopropnane の分子中に存在する、すべての重なり形相互作用の種類と数を数える。結合角のひずみによるエネルギーは、シクロプロパンの場合と同じであるものとして評価することができる。
なお、水素−水素の重なり形相互作用は 4.0 kJ/mol、水素−メチルの重なり形相互作用は 6.0 kJ/mol、メチル−メチルの重なり形相互作用は 11.0 kJ/mol であった。(プロパン、ブタン等の回転に伴うそれぞれの配座のエネルギーの数値より。)
(解答例)
cis-1,2-dimethylcyclopropnane のもつ全環ひずみエネルギー:126 kJ/mol
水素−水素の重なり形相互作用 × 3 = 12.0 kJ/mol
水素−メチルの重なり形相互作用 × 2 = 12.0 kJ/mol
メチル−メチルの重なり形相互作用 × 1 = 11.0 kJ/mol
結合角のひずみによるもの(シクロプロパンと同じとする) 91 kJ/mol
trans-1,2-dimethylcyclopropnane のもつ全環ひずみエネルギー:123 kJ/mol
水素−水素の重なり形相互作用 × 2 = 8.0 kJ/mol
水素−メチルの重なり形相互作用 × 4 = 24.0 kJ/mol
結合角のひずみによるもの(シクロプロパンと同じとする) 91 kJ/mol
以上の計算から、メチル基間の重なり形相互作用をもつ cis- 体の方がより大きな燃焼熱をもつ。
4.09
(解答例)
平面形を仮定すると、シクロペンタン中には全部で10組の水素−水素の重なり形の相互作用が存在するから、
10 × 4.0 kJ/mol = 40.0 kJ/mol
の(重なり形相互作用に由来する)ねじれひずみが存在することになる。
これが折れ曲がりにより 26.0 kJ/mol まで軽減されたとすれば、35 % の軽減である。
環ひずみは、結合角のひずみと重なり形相互作用によるねじれひずみからなる。
この計算では、平面型でも、折れ曲がったあとでも、結合角のひずみ無視できると仮定している。これは、正五角形の内角が 108 度であり、sp3 混成炭素の結合角と近いためである。(教科書 114 ページ 上半部分)
4.10
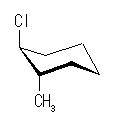
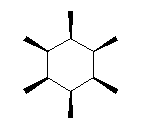
まずは、直感的な理解として、大きな置換基が近くにあればそれだけ反発が大きい。cis-1,3-dimethylcyclobutane の2つのメチル基に注目して考える。
更に、シクロブタン環の C2-C1 軸に沿った Newman 投影図を書いて、メチル基がどのような相互作用を持っているのかを考えると良い。
(解答例)
教科書の解答例にあるように、「2つのメチル基がより離れている (a) の配座の方が安定である。」
C3 炭素を C2-C1-C4 の3つの炭素のつくる平面に対して、持ち上げる、または下げることによって2つの立体配座 (b) および (a) ができるものと考えよう。
この2つの立体配座について、シクロブタン環の C2-C1 軸(緑矢印の方向)に沿った Newman 投影図を書くと、次図のようになる。
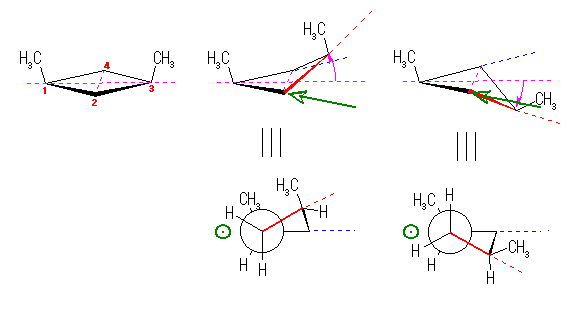
メチル基と水素は重なり形の相互作用が小さくなるように、C2-C1 軸が回転し(その結果として C3 炭素が上がったり、下がったりして)これらの立体配座を達成しており、完全な重なり形ではない。(教科書 118ページ)
このときに、図から判るように、C1 上のメチル基が隣接する炭素 C2 上の水素との間で持つ重なり形相互作用の大きさは、いずれの立体配座においても同じである。
しかし、立体配座 (b)(図、中央)では、C2-C3 結合に注目すると、C1-CH3 結合と C1-C4 結合の間にはさまれており、C1-CH3 結合との間に Gauche 的な相互作用を生じている。これが、立体配座 (a) よりも (b) の方が不安定となっている理由である。
4.11-4.20
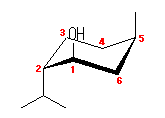
4.11
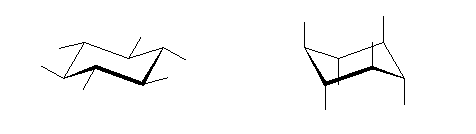
炭素−水素結合をふくめたいす形のシクロヘキサンの書き方は、教科書122ページ参照。この書き方は、練習して正しく書けるようになること。
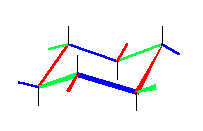
図のように、4組の平行線で描くことができる。アキシャル水素と炭素の結合(図中、黒線)は、環の平均的な平面に対して垂直な方向にひく。エカトリアル水素と炭素の結合(図中、赤、青、黄緑の線)は、その結合をひこうとしている炭素からひとつ離れた位置のシクロヘキサン環を構成する2本の結合(同色で示した)と平行にひく。
シクロヘキサノール(ヒドロキシシクロヘキサン)は、示性式で示すと、C6H11-OH。シクロヘキサンの水素のひとつを水酸基で置き換える。
水酸基がアキシャルにあるものとエカトリアルにあるものが、それぞれ環の反転による配座異性体となる。
(解答例)
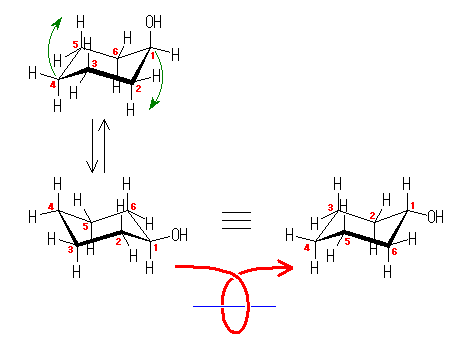
図、左の2つが環の反転により生じる配座異性体。上の配座での水酸基がアキシャル位、下の配座での水酸基はエカトリアル位にある。
環の面の上方に水酸基をもつシクロヘキサノールについて、炭素の番号をつけて環の反転の前後での対応を示してある。また、下方、右の立体配座は、環の上下を逆になるように、C1-C4軸に沿って回転させたもので、水酸基は同じエカトリアル位であるが、環の面の下方になっていることが判る。
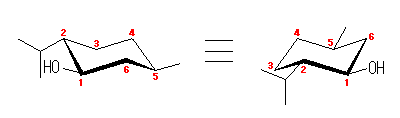
4.12
trans-1,4-dimethylcyclohexane では、1-methyl 基と 4-methyl 基の位置の組み合わせとしては、(上、下)または(下、上)の2種類があり得るが、対称な分子なので(C1-C4 軸に沿って180度回転させ、環の上下を入れ替えることが可能なので)、この2つは区別できない。そこで、一方のみについて考え、これを環反転させてやればよい。
(解答例)
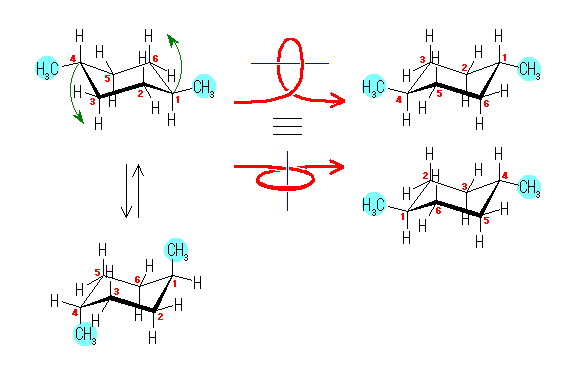
図、上段左は、1-methyl 基と 4-methyl 基の位置の組み合わせが(下、上)であるが、右図では、C1-C4 軸に沿った回転(または、環に垂直な軸に沿った回転)により(上、下)となっているが、左右とも同じものである。これらにおいては、2つのメチル基はともにエカトリアル位にある。
これに対し、これを環反転させた図下段では、1-methyl 基と 4-methyl 基の位置の組み合わせが(下、上)のままであるが、2つのメチル基ともアキシャル位にある。
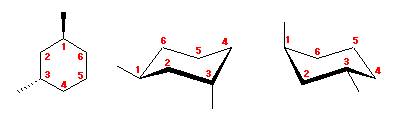
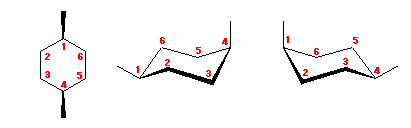
4.13
まず、左右の環反転の前後の図において、対応する炭素がどれか判るように 1 〜 6 の番号を振ってみること。このとき、環の構成炭素の作る平均的な面よりも持ち上がっていた炭素は、環の反転により下へいき、もともと環の平均面より下にあった炭素は上にくる。
(命名法的に考えると、緑の置換基の結合した炭素を 1 とし、順に右回りに番号を振るべきである。)
それぞれの炭素の置換基の位置が、環の上であるか下であるかは、環の反転によって変化しないので、同じ番号の炭素に、緑は下、赤も下、青も下、となるように置換基を置く。
(解答例)
 |
 | ||||
| 反転前 | 反転後 | 光学異性体 | |||
|---|---|---|---|---|---|
| 1-緑 | 下 | アキシャル | エカトリアル | 上 | エカトリアル |
| 2-赤 | 下 | エカトリアル | アキシャル | 上 | アキシャル |
| 4-青 | 下 | エカトリアル | アキシャル | 上 | アキシャル |
| ただ単に、環の反転でアキシャルとエカトリアルが入れ替わる、とだけ考えると、右のような光学異性体を描くことになってしまう。これは、環の反転によって生じる構造とは、空間内の平行移動や回転によって重ね合わせることは不可能である。 | |||||
 | 反転後 | ||||
| 下 | エカトリアル | ||||
| 下 | アキシャル | ||||
| 下 | アキシャル | ||||
| 変則的だが、このような書き方もできる。環の反転(環を構成する炭素の作る平均的な面よりも上にあった炭素(C2, C4, C6)は環の反転により下に、下にあった炭素(C1, C3, C5)は上にくる)を、同じ形のいす形シクロヘキサンの、炭素番号を一つずらして表現している。なお、環の反転で置換基の結合の上下は変化せず、アキシャルとエカトリアルが入れ替わっている。 | |||||
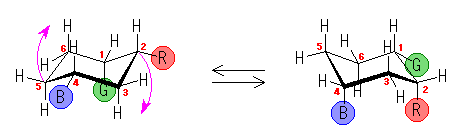
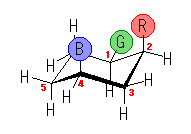
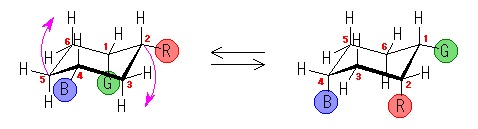
4.14
1,3-ジアキシャル相互作用の本質は、ゴーシュブタンの立体ひずみと同じ(教科書 p126、図4.20)であり、1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式(上図)で示されるような、C1-置換基と、C3-H の間のゴーシュ相互作用である。
この C1 上の置換基が、水素、メチル基、エチル基、イソプロピル基、t-ブチル基と変化していくときに、このゴーシュ相互作用の大きさはどのように変化するかを予測する。
もうひとつの有用な考え方は、このゴーシュ相互作用している置換基を、C1-置換基 軸の方向から(すなわち、シクロヘキサンの環の平面に(ほぼ)垂直な方向から)眺めてみることである。
(解答例)
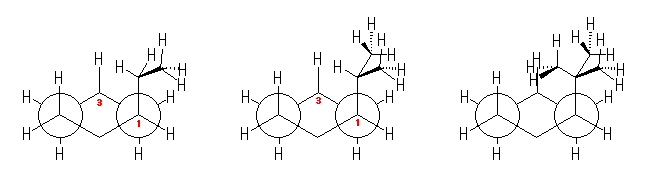
1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式を、置換基がエチル基、イソプロピル基、t-ブチル基と変化させて示した。
この図(および、ヒントで示した置換基がメチル基の時の Newman 投影式)を比較すると、t-ブチル基の時以外は、ゴーシュ相互作用の大きさが、ほぼ同じであることが予想できる。
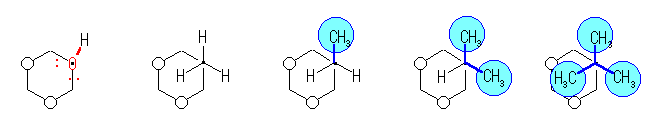
また、C1-置換基 軸の方向から(すなわち、シクロヘキサンの環の平面に(ほぼ)垂直な方向から)眺めた時の、1,3-ジアキシャル相互作用の様子を模式的に示した。ただし、白丸は、3位、および5位のアキシャル水素である。置換基は、左より、水酸基、メチル基、エチル基、イソプロピル基、t-ブチル基である。
水酸基では、酸素上の(水素より小さな)孤立電子対が3位、および5位のアキシャル水素と反発するだけであるのに対し、メチル基、エチル基、イソプロピル基では、置換基の中の C-H 結合が、また、t-ブチル基では、置換基の中の C-CH3 結合が、それぞれ3位、および5位のアキシャル水素と反発する。
これらの説明と、教科書 p126 表4.2 の値との対応を確認しておくこと。
4.15
本質的には、4.14 と同様に考えればよい。シアノ基( −C≡N )の炭素は、sp 混成をしているから、直線状の構造をしている。
(解答例)
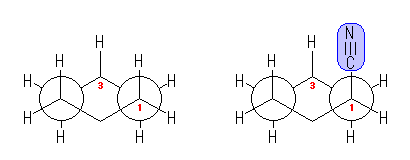
1-置換シクロヘキサンの、C1-C2(および C5-C4)軸方向からみた Newman 投影式を、置換基が水素およびシアノ基の場合について示した。シアノ基は直線状の構造(R-C-N の結合角が180度)であるから、図のようにまっすぐに伸びており、その結果として 1,3-ジアキシャル相互作用は小さい。(4.14 のヒントの、メチル基の場合の Newman 投影図と比較してみること。)
4.16
表 4.2 を読む際、「1つの 1,3-ジアキシャル相互作用の大きさ」を与えているのだから、1-bromocyclohexane において、1-Br がアキシャル位にあるとき、1-Br と 3-H の、そして 1-Br と 5-H の2つの 1,3-ジアキシャル相互作用を持つ。従って、表の値を2倍にしたものが、1-bromocyclohexane のもつ立体ひずみの量である。
(解答例)
表より、1-bromocyclohexane のもつ立体ひずみは、2 × 1.0 kJ/mol = 2.0 kJ/mol となる。
これを、教科書 p125 の図 4.18 にあてはめると、(下巻、付録D、p1281 に用意された解答とは若干ずれがあるが)臭素がアキシャル位にくる配座異性体の割合(不安定な異性体と書かれた赤い線から読む)は、およそ 25 % となる。
(発展)で述べた計算式を用いるなら、300 K において、>臭素がアキシャル位にある配座異性体の割合は、 31 % と計算される。
1 / ( 1 + e(2.0 / 2.5)) = 0.310
図 4.18 は、自分で関数電卓で値を計算することができる。
「物理化学」で習うように、並進や回転などの1自由度あたりに分配されるエネルギーは RT/2 (J/mol) である。室温( T〜300 K )で分子の持つエネルギーのおよその目安として、RT を計算すると、およそ 2.5 kJ/mol となる。
一方、ボルツマン分布によると、エネルギー差 ΔE の2つの状態間の占有度の比は e−(ΔE / RT)で与えられる。
すなわち、エネルギー差が 2.5 kJ/mol であるような二つの状態の間で平衡が成立しているなら、上の状態には下の状態に比べて 1/e 倍しか分布しないことを示す。このとき、全体に対する占有率は(1/(1+e)=)27%。以下、同様に計算すれば良いから、一般式として表しておくと、平衡にある状態間のエネルギー差が ΔE であるとき、300 K の温度において、その少ない方の存在割合は、 1 / ( 1 + e(ΔE / RT)) である。
なお、この計算式を用いたときの 300 K における種々の一置換シクロヘキサンのアキシャル体の存在割合の計算結果を示しておく。
| substituent | steric strain / kJ mol-1 | アキシャル体の存在割合 / % |
|---|---|---|
| -H | 0 | 50.0 |
| -F | 0.5 × 2 | 40.1 |
| -Br | 1.0 × 2 | 解答例参照 |
| -OH | 2.1 × 2 | 15.7 |
| -CH3 | 3.8 × 2 | 4.6 |
| -CH2CH3 | 4.0 × 2 | 3.9 |
| -CH(CH3)2 | 4.6 × 2 | 2.5 |
| -C6H5 | 6.3 × 2 | 0.64 |
| -C(CH3)3 | 11.4 × 2 | 0.011 |
4.17
1) まずは、いす形の立体配座のシクロへキサンをひとつ書き、立体配置が与えられた条件と合致するように置換基を書きこむ。
2) 次に、このシクロへキサン環の環反転をおこなう。(ひずみエネルギーの計算の目的には、実際には環反転では生じないような光学異性体を書いても構わない。つまり、アキシャルとエカトリアルをすべての置換基について入れ替えたペアを書くだけでもよい。)
3) それぞれの配座のうち、アキシャル位にある置換基についてのみ、1,3-ジアキシャル相互作用をもつから、表 4.2 を参照しながらひずみエネルギーを計算する。
4) シクロヘキサンの隣接する炭素上に置換基がある場合は、アキシャル同士の場合を除き、(すなわち、アキシャルとエカトリアルでも、エカトリアル同士でも)、2つの置換基間の gauche 形の相互作用も存在する。
5) 一般的に、より嵩高い置換基がエカトリアル位にある立体配座の方が安定である。
(解答例)
下図には、置換基と 1,3-ジアキシャル相互作用する水素を書きこんである。
| stable conformer | less stable conformer | ratio | ||
|---|---|---|---|---|
| (a) trans-1-chloro-3-methylcyclohexane | ||||
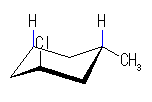 | 2.0 kJ/mol | 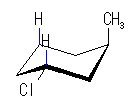 | 7.6 kJ/mol | ΔE = 5.6 kJ/mol 90.4 : 9.6 |
| (b) cis-1-ethyl-2-methylcyclohexane | ||||
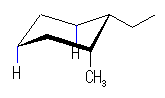 | 7.6 kJ/mol + 3.8 kJ/mol* |
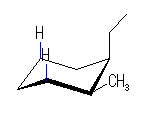 | 8.0 kJ/mol + 3.8 kJ/mol* |
ΔE = 0.4 kJ/mol 54.0 : 46.0 |
| (c) cis-1-bromo-4-ethylcyclohexane | ||||
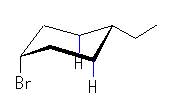 | 2.0 kJ/mol | 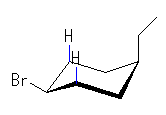 | 8.0 kJ/mol | ΔE = 6.0 kJ/mol 91.7 : 8.3 |
| (d) cis-1-tert-butyl-4-ethylcyclohexane | ||||
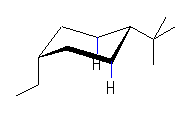 | 8.0 kJ/mol | 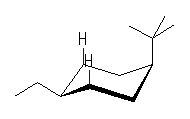 | 22.8 kJ/mol | ΔE = 5.6 kJ/mol 99.7 : 0.3 |
*: 隣接した炭素上の置換基(メチル基とエチル基)の gauche 相互作用によるひずみエネルギーへの寄与が存在する。
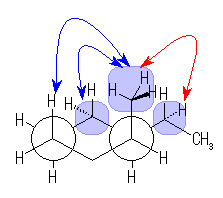
なお、(a) と (b) については、環反転では相互に変換されない、光学異性体のペアを示している。
4.18
1) 命名法については、教科書 pp 92-94 を参照すること。
シクロへキサン上に3つ置換基があり、置換基の種類によらずその位置だけから、環を構成する炭素の番号を決めることができる。
2) それぞれ3つの置換基について、アキシャルであるかエカトリアルであるかを、図より読み取る。
3) 環を反転させ(あるいは、ひずみエネルギーの見積もりだけの目的なら、すべての置換基についてアキシャルとエカトリアルを入れ換えるだけでもよい。これによって生じる異性体は、もとのものと光学異性体の関係にある。)、それぞれについてひずみエネルギーの大きさを見つもり、反転前と後でどちらが安定であるかを推定する。
(解答例)
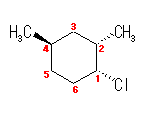
化合物名 : 1-chloro-2,4-dimethylcyclohexane
 | |||
| 反転前 | 置換基 | 反転後 | |
|---|---|---|---|
| アキシャル | 1-chloro | 下 | エカトリアル |
| 2 × 1.0 kJ/mol | − | ||
| エカトリアル | 2-methyl | 下 | アキシャル |
| − | 2 × 3.8 kJ/mol | ||
| アキシャル | 4-methyl | 上 | エカトリアル |
| 2 × 3.8 kJ/mol | − | ||
| 1,3-ジアキシャル相互作用によるひずみエネルギーの合計 | |||
| 9.6 kJ/mol* | ΔE = 2.0 kJ/mol | 7.6 kJ/mol* | |
2つのいす形配座のうち、図に与えられた(反転前の)立体配座の方が 2.0 kJ/mol だけ不安定である。このエネルギー差は、300 K での平衡条件で 31 % の不安定な配座と、69 % の安定な配座が存在することを示す。
4.19
この化合物が、もし、いす形の配座をとるとしたら、2つの置換基はどのような配置(アキシャル/エカトリアル)になるか。また、そのことによって、どの程度の 1,3-ジアキシャル相互作用によるひずみエネルギーを持つことになるかを見積もる。
これを環がいす形からねじれ舟形になるときにもつひずみエネルギー(23 kJ/mol, 教科書 p131)と比較することを考える。
(解答例)
いす形の立体配座では、2つの tert-butyl 基のうちいずれかがアキシャル位にくることになり、かなりの立体ひずみを持つことになる。ねじれ舟形の配座では、2つの tert-butyl 基がどちらもエカトリアル位にくることができるために、いす形からねじれ舟形になるときのひずみを補って安定となることができる。
定性的には、そういうことなのだが、定量的な説明をしようとするとうまくいかない(…気がする)。下の表参照。
trans-1,3-di-tert-butylcyclohexane の、いす形および(ねじれ)舟形2種の3つの配座異性体がある。( 1-tert-butyl 基は環よりも上、3-tert-butyl 基は環よりも下とした。この上下関係が逆であるものは、光学異性体となる。また、いす形と舟形のそれぞれの配座異性体は、C2, C3, C5, C6 のつくる平面よりも、C1, C4 をそれぞれ上下させて生じさせた。)
| 配座異性体 | その他のひずみ | 置換基 | |
| 1-tert-butyl 基 | 3-tert-butyl 基 | ||
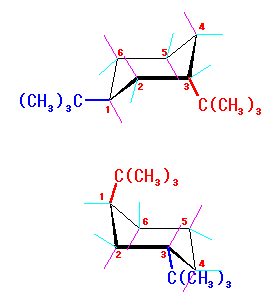 |
いす形 − | エカトリアル位 − | アキシャル位 2 × 11.4 kJ/mol |
| いす形 − | アキシャル位 2 × 11.4 kJ/mol | エカトリアル位 − | |
| 上のいす形の2つは、実は同じものである。 ( C2-C5 軸に沿って180度回転させることで、互いに重ね合わせることができる。) | |||
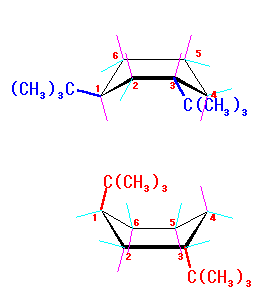 |
ねじれ舟形 23 kJ/mol | エカトリアル位 − | エカトリアル位 − |
| ねじれ舟形 23 kJ/mol | アキシャル位 C4-アキシャル水素との相互作用 | アキシャル位 C2,C5,C6-アキシャル水素との相互作用 | |
これらより、いす形の場合、主に tert-butyl 基の 1,3-ジアキシャル相互作用による、22.8 kJ/mol のひずみエネルギーを持つ。これに対し、ねじれ舟形(両 tert-butyl 基ともエカトリアル位にある場合)では、環の配座に由来して約 23 kJ/mol のひずみエネルギーを持つ。両者のエネルギーがほぼ同じであるとするならば、平衡にあるとき、両者の存在比はほぼ同じとなる。(問題文では、「主にねじれ舟形で存在する」と記述されているから、ここで行ったような単純な数値の推定とは異なるエネルギーを持っていると考える必要がある。) (発展)
同様な条件を持つものとして、他に cis-1,4-di-tert-butylcyclohexane などがある。
4.20
安定な構造を考えるのだから、デカリン(C10H10, decahydronaphthalene などの別名あり。)を構成するシクロヘキサン環部分をいす形で、cis-decaline と trans-decaline を描いてみる。
ひとつの環に注目して眺めたとき、もうひとつの環を構成するメチレンをメチル基と同様の1,3-ジアキシャル相互作用をもつ置換基であるとして、ひずみエネルギーについて見積もることができる。(教科書 p126、表 4.2 より、エチル基とメチル基による違いは小さい。これと同じように考えられる。)
(解答例)
cis-decaline (上)と trans-decaline (下)の構造を示す。左右とも同じものを表しており、左図、矢印の方向からの視点で見たものが右図となる。
橋頭位の水素は赤い結合で表した。これがシスになっているものが cis-decaline 、トランスになっているものが trans-decaline である。
ここで、黒で示したシクロヘキサン環を中心に考え、これに結合している置換基についてまとめておく。
| C1−Ha | C1−CH2(C10) | C6−Hb | C6−CH2(C7) | |
| cis-decaline | 上 | 下 | 上 | 下 |
| アキシャル | エカトリアル | エカトリアル | アキシャル | |
| アキシャル位の置換基は水素なので、1,3-ジアキシャル相互作用をもたない。 | アキシャル位の置換基は、青で示した環の一部をなすメチレン( -CH2- )なので、1,3-ジアキシャル相互作用がある。 | |||
| trans-decaline | 上 | 下 | 下 | 上 |
| アキシャル | エカトリアル | アキシャル | エカトリアル | |
| アキシャル位の置換基は水素なので、1,3-ジアキシャル相互作用をもたない。 | アキシャル位の置換基は水素なので、1,3-ジアキシャル相互作用をもたない。 | |||
4.21-4.30
4.21
(解答例)
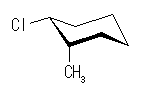
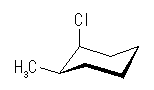
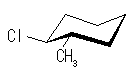
trans-1-chloro-3-methylcyclohexane
| 置換基 | 1-chloro | 3-methyl |
| 環平面の | 下 | 上 |
| a/e | エカトリアル | アキシャル |
| 置換基 | 1-chloro | 3-methyl |
| 環平面の | 下 | 上 |
| a/e | アキシャル | エカトリアル |
環の反転により、置換基の上下は入れ替わらないが、アキシャルとエカトリアルは入れ替わる。したがって、教科書の図に示されたいす型配座では、メチル基とシクロヘキサン環のアキシャル水素との間に、1,3-ジアキシャル相互作用が存在するのに対し、反転後の配座では塩素基とシクロヘキサン環のアキシャル水素との間に 1,3-ジアキシャル相互作用が存在する。
メチル基と塩素基では、メチル基の方が大きい置換基であるから、その 1,3-ジアキシャル相互作用もより大きいため、より不安定となる。
4.22
(解答例)
環の反転によっても、置換基の上下は入れ替わらない。従って、
| 置換基の色 | 2位-赤 | 4位-黄 | 1位-青 |
| 環平面の上下 | 上 | 上 | 上 |
| 環反転前 a/e | アキシャル | アキシャル | エカトリアル |
| 環反転後 a/e | エカトリアル | エカトリアル | アキシャル |
4.23
(解答例)
| |
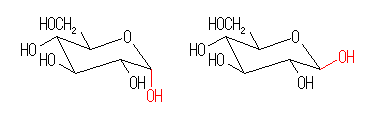
| α-glucose | β-glucose |
β-グルコースの方が安定。すべての置換基がすべてエカトリアル位にあるから。これに対し、α-グルコースは、エーテル酸素に隣接した炭素から出ている水酸基が、アキシャル位にある。
4.24
(a),(b) ねじれ形配座のうち、立体的に大きな置換基どうし(メチル基など)が アンチ形になっているものが一番安定。重なり形配座のうち、立体的に大きな置換基どうし(メチル基など)が重なるものが一番不安定。
(c) 問いに与えられた数値の他に、教科書 112 ページ 表 4.1 より、水素−水素の重なり形相互作用は 4.0 kJ/mol、水素−メチルの重なり形相互作用は 6.0 kJ/molの値を用いる。
(解答例)
(a) 下の図の2種類のねじれ形配座が考えられるが、より安定なのは左。
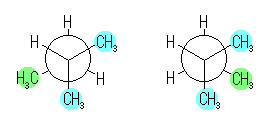
(c) のような定量的な見積もりにより、これら二つの配座の間のエネルギー差は、3.8 kJ/mol。これは、(発展)で示した根拠によれば、2つの配座だけを考えたとして、左のより安定な配座にある分子は右のねじれ形配座にある分子の5倍程度存在することを示す。
(b) 下の図の2種類の重なり形配座が考えられるが、より不安定なのは右。
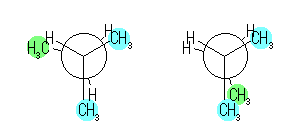
一番不安定な重なり形配座と一番安定なねじれ形配座のエネルギー差は、17.2 kJ/mol。この値は、2つの配座だけを考えたとして、安定なねじれ形配座にある分子の数が、不安定な重なり形配座にある分子の約1000倍であることを示す。
(c) 以下のようになる。
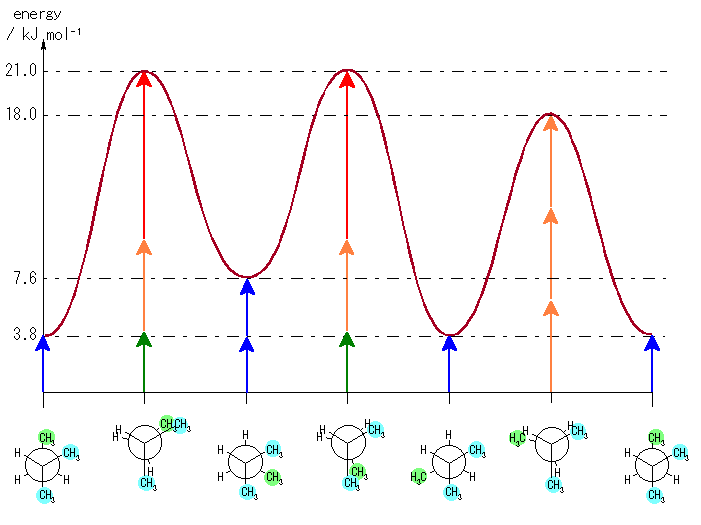
ただし、以下のようなエネルギーの見積もりによる。
ゴーシュ相互作用:
水素−水素 0 kJ/mol
水素−メチル 0 kJ/mol
メチル−メチル 3.8 kJ/mol (青矢印)
重なり形相互作用:
水素−水素 4.0 kJ/mol (緑矢印)
水素−メチル 6.0 kJ/mol (橙矢印)
メチル−メチル 11.0 kJ/mol (赤矢印)
「物理化学」で習うように、並進や回転などの1自由度あたりに分配されるエネルギーは RT/2 (J/mol) である。室温( T〜300 K )で分子の持つエネルギーのおよその目安として、RT を計算すると、およそ 2.5 kJ/mol となる。
一方、ボルツマン分布によると、エネルギー差 ΔE の2つの状態間の占有度の比は e−(ΔE / RT)で与えられる。
すなわち、エネルギー差が 2.5 kJ/mol であるような二つの状態の間で平衡が成立しているなら、上の状態には下の状態に比べて 1/e 倍しか分布しないことを示す。このとき、全体に対する占有率は(1/(1+e)=)27%。( 5.0 kJ/mol では、1/e2 倍(12%)、7.5 kJ/mol では、1/e3 倍(4.7%)、10.0 kJ/mol では、1/e4 倍(1.8%)、12.5 kJ/mol では、1/e5 倍(0.67%)、15.0 kJ/mol では、1/e6 倍(0.25%)、17.5 kJ/mol では、1/e7 倍(0.091%)、20.0 kJ/mol では、1/e8 倍(0.034%)、22.5 kJ/mol では、1/e9 倍(0.012%)、25.0 kJ/mol では、1/e10 倍(0.0045%)となる。)
参照 教科書p107(下から2行)
これを、エタンの重なり形配座にいる分子の割合を求めるのに使用してみる。ねじれ形配座と重なり形配座では、12.0 kJ/mol のエネルギー差があるので、その存在度の比は、 e(12 / 2.5) : 1 となるから、全分子中の重なり形配座の数を求める(この2つしか配座が存在しないものとして)計算式は、1 / (1 + (e(12 / 2.5))) となり、これを計算すると、0.008162 で、約 0.82 % となる。(教科書の記述に一致する。)
以上の議論を元にして、教科書p112(注意点)を読み、その意味を理解すること。
4.25
水素−水素 0 kJ/mol
水素−メチル 0 kJ/mol
メチル−メチル 3.8 kJ/mol
を用いる。
(解答例)
2,3-dimethylbytadiene の構造は、以下の通り。
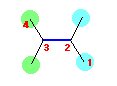
従って、以下の3つのねじれ形配座が可能である。
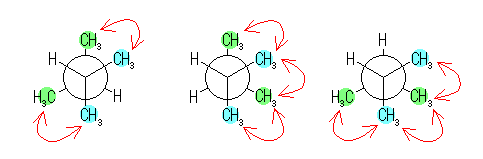
このうち、左のもの(2つの水素がアンチ形にあるもの)では、メチル−メチルのゴーシュ相互作用が2つであるのに対し、残りの二つ(2つの水素がゴーシュ形にあるもの)では、メチル−メチルのゴーシュ相互作用が3つある。したがって、これらの間のエネルギー差は、3.8 kJ/mol である。
なお、4.24 と同様に定量的なエネルギー図を描くと、以下のようになる。
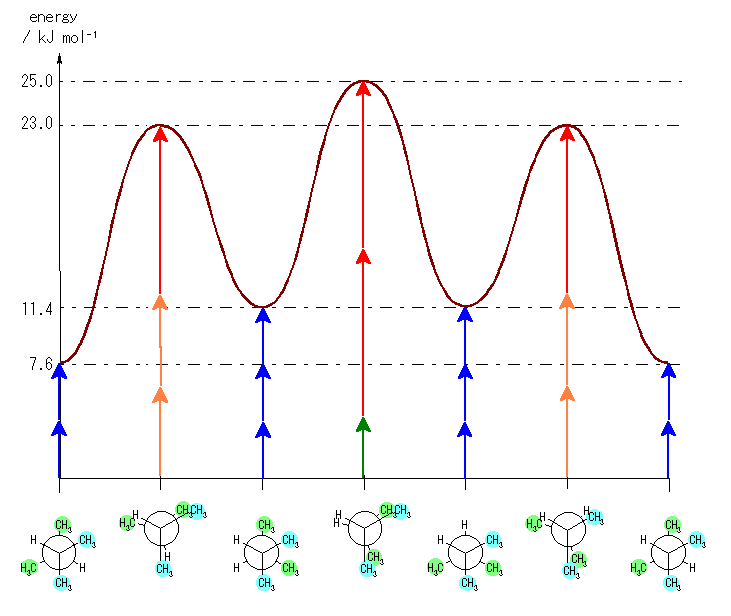
ただし、以下のようなエネルギーの見積もりによる。
ゴーシュ相互作用:
水素−水素 0 kJ/mol
水素−メチル 0 kJ/mol
メチル−メチル 3.8 kJ/mol (青矢印)
重なり形相互作用:
水素−水素 4.0 kJ/mol (緑矢印)
水素−メチル 6.0 kJ/mol (橙矢印)
メチル−メチル 11.0 kJ/mol (赤矢印)
4.26
1,2-dibromoethane の臭素をメチル基に置換したものは、n-butane であるから、1,2-dibromoethane の C-C 結合軸の回転に関するエネルギーと、n-butane の C2-C3 結合軸の回転に関するエネルギー(教科書 p110 図 4.5)は同じような関係を持つはずである。
(解答例)
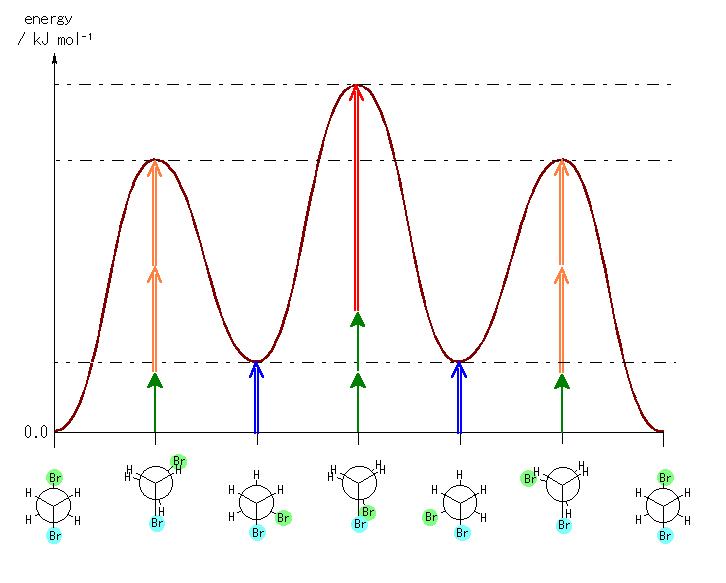
ただし、以下のようなエネルギーの見積もりによる。
ゴーシュ相互作用:
水素−水素 0 kJ/mol
水素−臭素 0 kJ/mol
臭素−臭素 (青矢印)
重なり形相互作用:
水素−水素 (緑矢印) 4.0 kJ/mol
水素−臭素 (橙矢印) 7.0 kJ/mol ← 問題 4.28 より
臭素−臭素 (赤矢印)
ここで、およその大きさは、n-butane の C2-C3 結合軸の回転に関するエネルギー(下図)を参照とした。
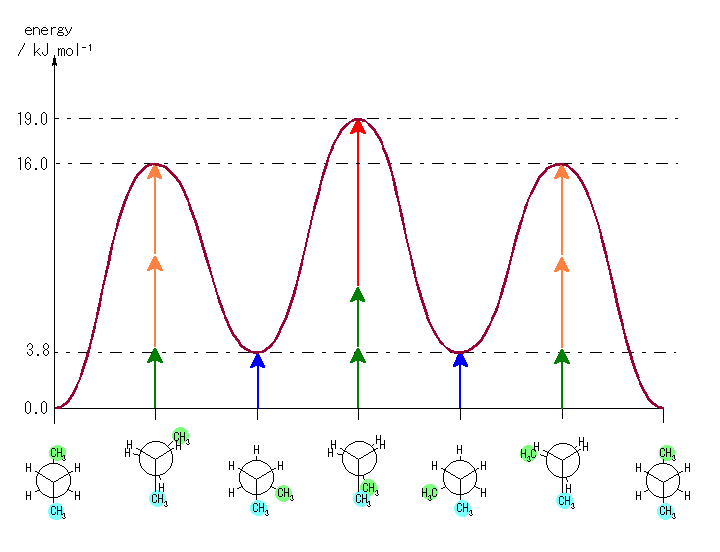
ただし、以下のようなエネルギーの見積もりによる。
ゴーシュ相互作用:
水素−水素 0 kJ/mol
水素−メチル 0 kJ/mol
メチル−メチル 3.8 kJ/mol (青矢印)
重なり形相互作用:
水素−水素 4.0 kJ/mol (緑矢印)
水素−メチル 6.0 kJ/mol (橙矢印)
メチル−メチル 11.0 kJ/mol (赤矢印)
4.27
(解答例)
最大の双極子モーメントを持つ立体配座は、2つの臭素が重なり形をとるもの。
一番安定な配座は、2つの臭素がアンチとなる立体配座である。この形から予測される分子の双極子モーメントはゼロとなるが、実験的に μ = 1.0 D の双極子モーメントが観測されている事実より、2つの臭素がゴーシュとなる立体配座も有意な量だけ存在しており、分子の双極子モーメントに寄与していると考えられる。
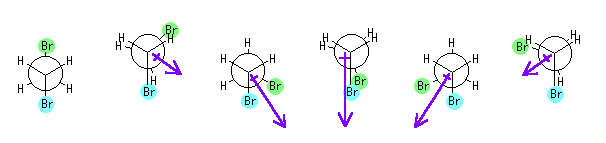
1,2-dibromoethane のそれぞれの回転配座に対応する双極子モーメントの方向を矢印で書き込んだ。また、これらの配座のエネルギーの定量的な取り扱いと、これに基づいたそれぞれの配座の寄与の定量的な議論は、以下のようになる。
図の下の数値は、ボルツマン分布より予測される相対的な存在度。
| ||||||||||
| 1 | : | 1/e(18/2.4) | : | 1/e(5/2.4) | : | 1/e(20/2.4) | : | 1/e(5/2.4) | : | 1/e(18/2.4) |
図左端、一番安定なねじれ形配座では臭素同士がアンチ配座をとっており、炭素−臭素の分極は互いに打ち消し合うため、分子は双極子モーメントを持たない。
左より2番目、2組の臭素と水素が重なり形となる配座では、分子は、炭素−臭素の分極と同程度の双極子モーメントを持つ。また、4.28 の問題より、水素−臭素の重なり形相互作用の大きさが 7.0 kJ/mol と求まる(水素−メチルの重なり形相互作用では 6.0 kJ/mol であったことを考えると、臭素の方がメチル基より、少し大きいと考えられる)ので、これに基づけば、18 kJ/mol のエネルギーであることになる。したがって、0.15% 程度の寄与しかない。[ 計算式 : 2 / (2 + (e^(18 / 2.5))) = 0.00149 ] )。
左より3番目、臭素と臭素がゴーシュになる配座は、炭素−臭素の分極の 1.7 倍程度の双極子モーメントを持つ。n-butane からの類推より、5 kJ/mol 程度のエネルギーであると仮定して 20% 程度の寄与があることになる。[ 計算式 : 2 / (2 + (e^(5 / 2.5))) = 0.213 ] 。
臭素と臭素が重なり形となる配座では、双極子モーメントは最大となり、炭素−臭素の分極の 2 倍程度となる。この配座は、n-butane からの類推より、少なくとも20 kJ/mol 程度の不安定な配座であると仮定すると、0.04% 未満の寄与しかないと考えられる。[ 計算式 : 1 / (1 + (e^(20 / 2.5))) = 0.000335 ])
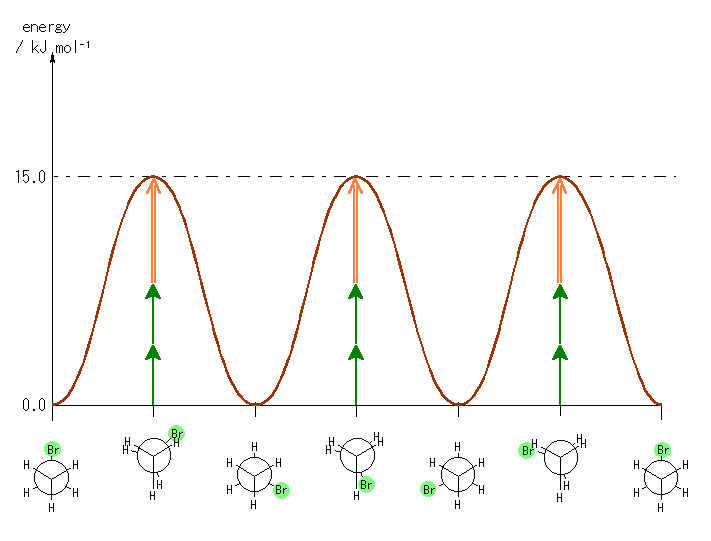
4.28
(解答例)
(a) 7.0 kJ/mol [ 計算式 : 15.0 − (4.0 × 2) = 7.0 ]
(b) 以下の通り。
4.29
「どのアルカンにおいても、最も安定な配座は、すべてのC−C結合がねじれ型で、大きな置換基(注目しているC−C結合からでているアルキル基)が互いにアンチに配列するものである。」
(解答例)
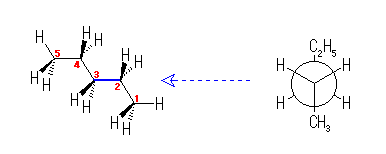
左図のように、すべての炭素が直線的に伸びた立体配座をとる。このとき、C2-C3 結合軸にそった Newman 投影図(右図)を見ると、大きな置換基である手前のメチル基(C1)と向こう側のエチル基(C4-C5)が互いにアンチになったねじれ形をとっていることがわかる。
4.30
(解答例)
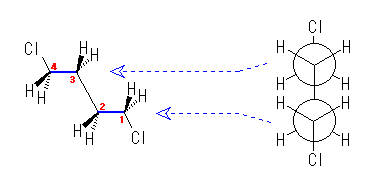
左図のように、すべての炭素と2つの塩素が直線的に伸びた立体配座をとる。このとき、C1-C2 結合軸、およびC3-C4 結合軸にそった Newman 投影図(右図)を見ると、大きな置換基である塩素とアルキル基が互いにアンチになったねじれ形をとっていることがわかる。
4.31-4.40
4.31

図のように、4組の平行線で描くことができる。アキシャル水素と炭素の結合(図中、黒線)は、環の平均的な平面に対して垂直な方向にひく。エカトリアル水素と炭素の結合(図中、赤、青、黄緑の線)は、その結合をひこうとしている炭素からひとつ離れた位置のシクロヘキサン環を構成する2本の結合(同色で示した)と平行にひく。
(解答例)
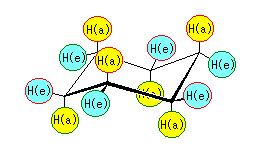
ただし、アキシャル位の水素は H(a) で示し黄色で、エカトリアル位の水素は H(e) で示し水色で、それぞれ記した。
また、シクロヘキサン環の平面に対して上の水素は赤丸で、下の水素は緑丸で囲んである。アキシャル位の水素6つのうち、半分の3つは環の上方に、残りの3つは環の下方に結合している。また、エカトリアル位の水素6つのうち(ひとつおきの炭素に結合した)3つは環の上方で、残りの3つは環の下方である。
なお、この図を C1-C2 軸および C5-C4 軸方向から見た Newman 投影図と対応させておこう。
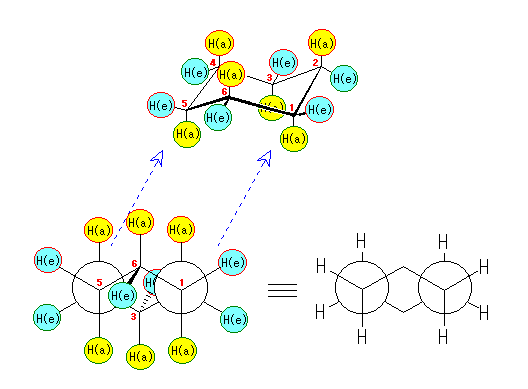
この図からも、すべてのアキシャル水素(黄色)が環のなす平面に対して垂直な方向にでており、またエカトリアル水素(水色)が環のペリフェラルな(環の縁の方向を向いた)方向にでていることがわかる。また、赤丸で囲んだ6つの水素(3つはアキシャル、3つはエカトリアル)は、環の上方に結合しており、緑色で囲んだ6つの水素(3つはアキシャル、3つはエカトリアル)は、環の下方に結合している様子も見てとれる。
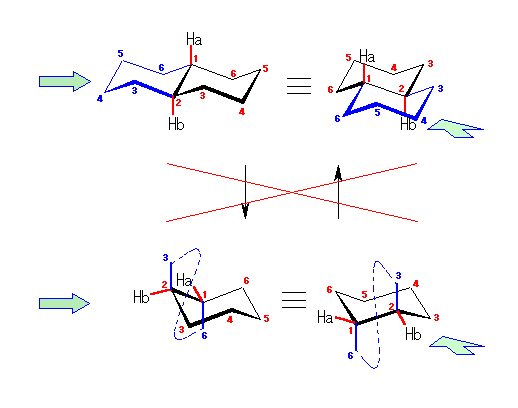
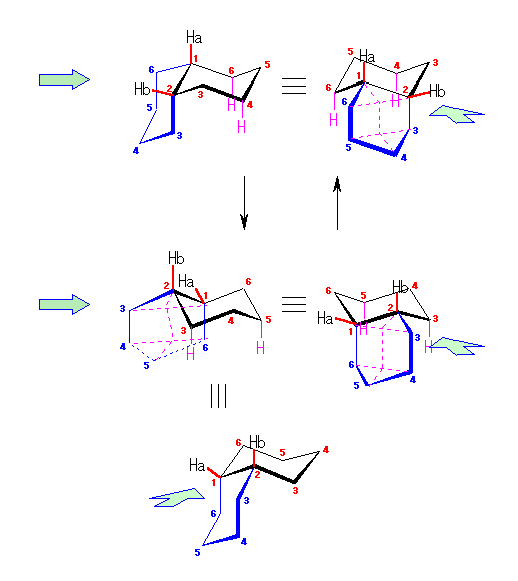
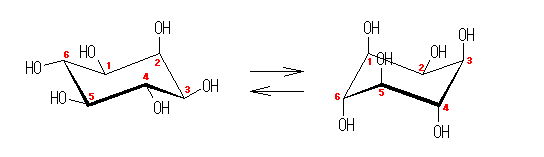
また、このいす形配座のシクロヘキサンの環反転について考えてみよう。
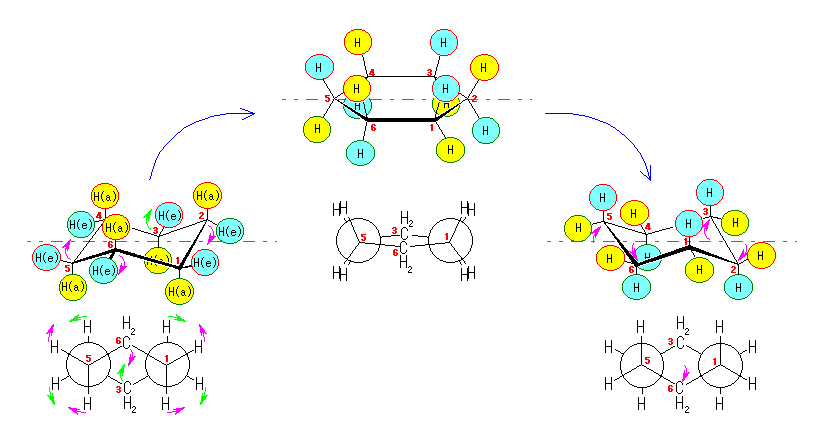
まず、この「いす形配座」のシクロヘキサンの水素のマーキングはそのままにして、6つの炭素が同一平面内にくるようにしてみよう。Newman 投影図との対応で考えるために、C1、C2、C4、C5 の4つの炭素を固定したまま、C3 を環の上方へ、C6 を環の下方へ折り返す。実際には、隣りあった炭素を交互に上げ下げすることに対応する。(分子モデル等でためしてみると判りやすい。)この動きの際に、炭素−炭素結合の軸に沿ってのねじれ(回転)が生じ、立体配座はねじれ形から重なり形に近づく。
図の中央に示したように、この配座においては、任意の炭素−炭素結合に注目すると、いずれも水素が重なり形となっており、エネルギー的に不利な立体配座である。
C3 の環の上方へ、C6 の環の下方への動きをそのまま続行させると、環反転がおきる(図右)。左側のいす形配座では、環のなす平均的な平面より上のある炭素は、C2、C4、C6 であったのが、環の反転とともに C1、C3、C5 に入れ替わり、同時にエカトリアル位にあった水素はすべてアキシャル位に、またアキシャル位にあった水素はすべてエカトリアル位に移動している。(ただし、水素が結合している方向が環の平均的な面に対して上か下かについては、変化しない。)
4.32
(解答例)
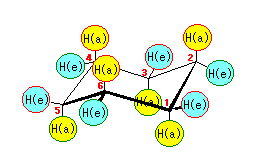 シクロヘキサンの環を構成する炭素に1から6までの番号を振り、それぞれに結合した水素(環の上方、および環の下方)について、ある「いす形配座」におけるアキシャルとエカトリアルの関係を表にまとめると、以下のようになる。
シクロヘキサンの環を構成する炭素に1から6までの番号を振り、それぞれに結合した水素(環の上方、および環の下方)について、ある「いす形配座」におけるアキシャルとエカトリアルの関係を表にまとめると、以下のようになる。
| 反転前 | 反転後 | ||
|---|---|---|---|
| 1位 | 上 | エカトリアル | アキシャル |
| 下 | アキシャル | エカトリアル | |
| 2位 | 上 | アキシャル | エカトリアル |
| 下 | エカトリアル | アキシャル | |
| 3位 | 上 | エカトリアル | アキシャル |
| 下 | アキシャル | エカトリアル | |
| 4位 | 上 | アキシャル | エカトリアル |
| 下 | エカトリアル | アキシャル | |
| 5位 | 上 | エカトリアル | アキシャル |
| 下 | アキシャル | エカトリアル | |
| 6位 | 上 | アキシャル | エカトリアル |
| 下 | エカトリアル | アキシャル | |
cis-1,2-二置換シクロヘキサンでは、2つの置換基は両方とも環の上、または両方とも環の下に結合しているから、いす型の立体配座をとるとき、必ず2つの置換基は一方がアキシャルで、もう一方はエカトリアルになる。これは、環の反転によっても(アキシャルとエカトリアルが相互に変化するだけで)変わらない。
4.33
(解答例)
(省略)4.32と同じ表を使って考えてみよ。
4.34
(解答例)
cis-体は、2つの置換基が(アキシャル、アキシャル)または、(エカトリアル、エカトリアル)の位置に来るのに対し、trans-体では、環の反転があっても常に(アキシャル、エカトリアル)の組み合わせになる。これらの配座の中で一番安定なのは、立体的に大きな置換基がすべてエカトリアル位にある配座だから、2つの置換基がどちらもエカトリアルに来ることのできる cis-体の方が trans-体にくらべて安定である。(2つの置換基が両方ともアキシャルになる配座は trans-体よりも不安定であるが、より安定な配座のみをとる。)
4.32 の解答例で示した表の一部を抜粋する。
| 反転前 | 反転後 | ||
|---|---|---|---|
| 1位 | 上 | エカトリアル | アキシャル |
| 3位 | 上 | エカトリアル | アキシャル |
| 反転前 | 反転後 | ||
|---|---|---|---|
| 1位 | 上 | エカトリアル | アキシャル |
| 3位 | 下 | アキシャル | エカトリアル |
4.35
(解答例)
| 反転前 | 反転後 | ||
|---|---|---|---|
| 1位 | 上 | エカトリアル | アキシャル |
| 4位 | 上 | アキシャル | エカトリアル |
| 反転前 | 反転後 | ||
|---|---|---|---|
| 1位 | 上 | エカトリアル | アキシャル |
| 4位 | 下 | エカトリアル | アキシャル |
4.36
シクロブタンの4つの炭素を同一平面内の、正方形の頂点に配置すると、結合角は直角で、水素はすべて重なり形の配座になっている。この水素の重なり形になることによるひずみ(ねじれひずみ)を避けるために、4つの炭素のうち対角にある2つを平面より持ち上げたような、折れ曲がった立体配座をとる。これにより炭素−炭素−炭素の結合角は90度より小さくなるため、結合角のひずみは増えるが、ねじれひずみが解消される分で補われる。ただし、完全なねじれ型配座になるほど分子を変形させると結合角をかなり小さくしなくてはならず、結合角のひずみの増加分が大きくなりすぎるので、一つの炭素が残りの3つの炭素がつくる平面から約25度だけ上にあるような立体配座となり、隣接した炭素に結合した水素は、完全な重なり形ではないが、ねじれ形でもない中間である。
シクロブタンの立体配座の詳細については、教科書118ページを参照。
(解答例)
1,2-dimethylcyclobutane の立体配置と、それに対応する立体配座を、Newman 投影式で示した。
左の立体配置は、cis-体である。右の2つは、trans-体であるが、異なる立体配座をもつ。これらの中では、2つのメチル基がより遠くなった、trans-体のとる中央に示された立体配座が最も安定である。
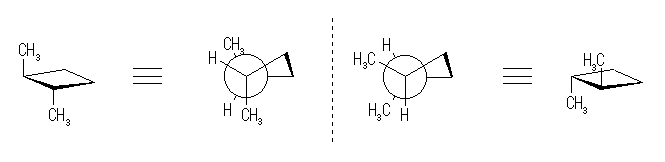
1,3-dimethylcyclobutane の立体配置と、それに対応する立体配座を示した。

左の2つは、cis-体のもので、環の反転により生じる配座異性体である。右の2つは、trans-体の立体配座であるが、どちらも同じである(上下を入れ替えるように回転させると、重ねあわせることができる)。これらの中では、2つのメチル基がより遠くなった、cis-体のとる左から2番目の立体配座が最も安定である。
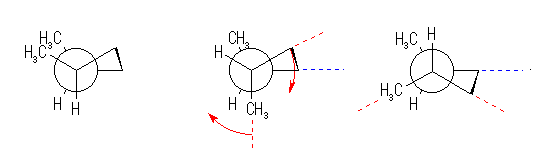
なお、次に示す二つのtrans-1,2-dimethylcyclobutane は、互いに光学異性体であるので、厳密には、この二つは互いに重ねあわせることができない。(環の反転などによっても、互いに入れ替わらない。)
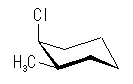
4.37
(解答例)
二つの立体配座異性体は、環の反転に伴い、次の表のように置換基のアキシャルとエカトリアルが入れ替わるから、下図のようになる。
| 置換基 | 反転前 1 | 反転後 2 | |||
|---|---|---|---|---|---|
光学異性体 A
| 1-chloro group 環の上 |
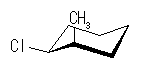
| エカトリアル |
| アキシャル |
| 2-methyl group 環の上 | アキシャル | エカトリアル | |||
| 立体ひずみ | 3.8 kJ/mol × 2 | 1.0 kJ/mol × 2 | |||
| 1.0 kJ/mol* | 1.0 kJ/mol* | ||||
| 光学異性体 A と B は、環の反転では入れ替わらない。 | |||||
光学異性体 B 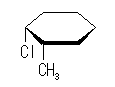
| 1-chloro group 環の下 |
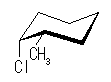
| アキシャル |
| エカトリアル |
| 2-methyl group 環の下 | エカトリアル | アキシャル | |||
| 立体ひずみ | 1.0 kJ/mol × 2 | 3.8 kJ/mol × 2 | |||
| 1.0 kJ/mol* | 1.0 kJ/mol* | ||||
ある置換基がアキシャル位にあるときの、水素1つとの間の 1,3-ジアキシャル相互作用の大きさは、教科書 p126 の表4.2 に与えられている。それぞれの置換基は、2つの水素との間で1,3-ジアキシャル相互作用するから、この値を倍にしたものが、それぞれの立体配座異性体のもつ立体ひずみの大きさである。したがって、メチル基がエカトリアル位にあり、塩素がアキシャルに結合した配座異性体の方が、もう一方よりも 5.6 kJ/mol だけ安定である。
なお、いす形のシクロヘキサン環骨格の書き方には、左が下がるタイプと右が下がるタイプがあり、環の反転ではこの二つが互いに入れ替わる。(と、同時にアキシャル位とエカトリアル位が入れ替わる。)
従って、このタイプを入れ替えずにアキシャル位とエカトリアル位の置換基だけを入れ替えると、相互に変換不可能な光学異性体を描くことになってしまう。
つまり、 (A-1)
 は、環の反転によって、 (B-2)
は、環の反転によって、 (B-2)
 ではなく、 (A-2)
ではなく、 (A-2)
 となる。 (A-2) は、
となる。 (A-2) は、
 と描くこともできる。
と描くこともできる。
4.38
(解答例)
二つの立体配座異性体は、環の反転に伴い、次の表のように置換基のアキシャルとエカトリアルが入れ替わるから、下図のようになる。
| 置換基 | 反転前 1 | 反転後 2 | |||
|---|---|---|---|---|---|
光学異性体 A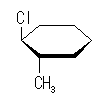
| 1-chloro group 環の上 |
| エカトリアル |
| アキシャル |
| 2-methyl group 環の下 | エカトリアル | アキシャル | |||
| 立体ひずみ due to (upper) 1,3-diaxial, and (lower) gauche* interactions, respectively. | 0 kJ/mol | 1.0 kJ/mol × 2 + 3.8 kJ/mol × 2 | |||
| 1.0 kJ/mol | 0 kJ/mol | ||||
| 光学異性体 A と B は、環の反転では入れ替わらない。 | |||||
光学異性体 B 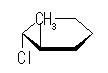
| 1-chloro group 環の下 |
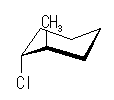
| アキシャル |
| エカトリアル |
| 2-methyl group 環の上 | アキシャル | エカトリアル | |||
| 立体ひずみ due to (upper) 1,3-diaxial, and (lower) gauche* interactions, respectively. | 1.0 kJ/mol × 2 + 3.8 kJ/mol × 2 | 0 kJ/mol | |||
| 0 kJ/mol | 1.0 kJ/mol | ||||
 ある置換基がアキシャル位にあるときの、水素1つとの間の 1,3-ジアキシャル相互作用の大きさは、教科書 p126 の表4.2 に与えられている。
ある置換基がアキシャル位にあるときの、水素1つとの間の 1,3-ジアキシャル相互作用の大きさは、教科書 p126 の表4.2 に与えられている。一方の立体配座では、2つの置換基がジエカトリアルあり、 gauche 相互作用している。また、もう一方の立体配座では、アキシャル位にある2つの置換基が環の上下にあって、どちらもそれぞれ2つの水素との間で 1,3-ジアキシャル相互作用している。これらより、ジアキシャル配座はジエカトリアル配座よりも 8.6 kJ/mol だけ不安定である。
4.39
1) まず酸素を含む6員環(オキサシクロヘキサン)を、いす形の立体配座で書く。
この時、酸素の置き方に2種類あり得る。すなわち、構成原子のなす平均的な平面より上に酸素を置く方法と、下に置く方法である。
2) それぞれの炭素上に、-CH2OH(ヒドロキシメチル基)、-OH(水酸基)を問題の条件に合致するように置いていく。
(解答例)
 都合上(教科書(下)での、糖類の構造式と一致させる目的で)、ここでは教科書とはガラクトースの絵を左右反転して示している。また、環の命名法とは異なった規則により(酸素には番号を振らずに)炭素骨格に1〜6の番号を振っている。
都合上(教科書(下)での、糖類の構造式と一致させる目的で)、ここでは教科書とはガラクトースの絵を左右反転して示している。また、環の命名法とは異なった規則により(酸素には番号を振らずに)炭素骨格に1〜6の番号を振っている。
赤で示した水酸基はアキシャルに、それ以外の置換基はすべてエカトリアルにくるようにする。
このような条件を満たすものは、以下の2通りが考えられる。いずれも正解である。
左右の2つは互いに光学異性体の関係にある。下の表を見よ。酸素の位置を好きな位置においたとしても、それぞれの置換基の結合方向が環に対して上か下かで分類すると、この2種類のいずれかと同じであることが判るはずである。なお、天然に多く存在しているのは、青い破線よりも右側の構造のものである。
| 左の立体異性体(L体) | 右の立体異性体(D体) | |
|---|---|---|
| 1位 ヒドロキシル基 | 下 | 上 |
| 2位 ヒドロキシル基 | 上 | 下 |
| 3位 ヒドロキシル基 | 下 | 上 |
| 4位 ヒドロキシル基 | 下 | 上 |
| 5位 ヒドロキシメチル基 | 下 | 上 |
糖類の構造と名称に関しての系統的な学習は、教科書25章で行う。
ガラクトースは、乳糖(ラクトース)の成分。乳糖はラクターゼという酵素により加水分解されて、ガラクトースとグルコースを与える。
4.40
1) まず、炭素に番号をつける。
( → 発展の項も参照)
2) その番号が時計回り(右回り)になるように見る方向を、上から見ているものとして環の上下を定義するならば(すなわち教科書の図の通りに、上下を決めるならば)、それぞれの置換基の結合している方向は、2位のイソプロピル基は環の下、1位の水酸基は環の上、5位のメチル基も環の上となる。
3) シクロヘキサン環を、いす型構造で書き、任意の位置を1とし、上から見て右回りになるように番号を振る。
4) 1)および2)の情報に矛盾しないように、それぞれの置換基を書き込み、それぞれアキシャル位にくるのか、エカトリアル位にくるのかを調べる。
5) 4)で書いたいす形配座異性体の立体構造から、環の反転をおこさせる。その際、以下の事に注意すること。
5-2) 反転前に、環をなす6個の炭素の平均的な面より上にあった炭素は、反転後には下方にある。
5-3) それぞれの置換基が結合している方向が上であるか下であるか、は、反転により変化しない。
5-4) 反転により、アキシャル位とエカトリアル位は互いに入れ替わる。
6) 反転させた後のいす形配座の立体構造から、それぞれの置換基がアキシャル位にあるのか、エカトリアル位にあるのかを調べる。
7) 簡易的に考えて、よりたくさんの、そしてより大きな置換基がエカトリアル位にある方が安定である。
7-2) 厳密には、教科書126ページの表を用いながら、1,3-ジアキシャル相互作用に由来するような立体ひずみ、および隣接した環炭素の上の置換基間のゴーシュ相互作用による立体ひずみの合計を計算し、この値がより小さい方が安定であると結論する。ただし、この化合物の場合には、実際にはこの表から大きさを求められないような相互作用も存在している。
(解答例)
可能な2つのいす型配座を書くと次のようになる。ただし、環の番号を振る回り方とそれぞれの置換基が結合する方向(上下)は、入れ替わらないように書いてあることに注意せよ。
すべての置換基がエカトリアル位にくる方のいす型配座(下図、右)の方が安定である。
 |
 | |
| 1-hydroxy | 上 | 上 |
| アキシャル | エカトリアル | |
| 2.1 kJ/mol*1 > 3.8 kJ/mol*2 | > 2.1 kJ/mol*5 | |
| 2-isopropyl | 下 | 下 |
| アキシャル | エカトリアル | |
| 2 × 4.6 kJ/mol*3 | − | |
| 5-methyl | 上 | 上 |
| アキシャル | エカトリアル | |
| 3.8 kJ/mol*4 | − | |
| strain | > 18.9 kJ/mol | > 2.1 kJ/mol |
また、慣用名としてメントールを用いる際には、その慣用的な番号も別に存在する。メチル基の根元の炭素 C1とし、水酸基の根元 C3、イソプロピル基の根元 C4 となるように環を構成する炭素に6まで番号を振り、メチル炭素をC7、イソプロピル炭素を C8からC10となるように番号を振る。
4.41-4.50
4.41
それぞれの一置換シクロヘキサンについて、アキシャル位に置換基がある場合のひずみエネルギーを、表 4.2 より求め、ΔE とする。この際、表 4.2 の値は、置換基と水素の間のひとくみの 1,3-ジアキシャル相互作用の大きさを与えていることに注意する。また、置換基がエカトリアル位にあるときには、ひずみエネルギーがゼロであるものとし、二つのいす形立体配座の間のエネルギー差を求めること。
これらの値を用い、図 4.18 または、ボルツマン分布の式より T=300K (RT=2.5 kJ/mol) として、それぞれの配座での存在比を求めることができる。
(解答例)
以下の表のとおり。一番右のカラムが、エネルギーの高い状態、すなわち置換基がアキシャル位にくるものが全体に占める割合。
| substituent | strain due to 1,3-diaxial interaction, ΔE | e( ΔE / RT ) |
| |||||||||
| (a) R = CH(CH3)2 | 2 × 4.6 kJ/mol | 39.7 | 2.5 % | |||||||||
| (b) R = F | 2 × 0.5 kJ/mol | 1.5 | 40 % | |||||||||
| (c) R = CN | 2 × 0.4 kJ/mol | 1.4 | 42 % | |||||||||
| (d) R = OH | 2 × 2.1 kJ/mol | 5.4 | 16 % | |||||||||
4.42
実際にいす形立体配座で、ひとつの立体構造を書いてみるとよい。
ある置換基は、環の反転によりアキシャル位とエカトリアル位が入れ替わることを思い出すと、必ずしも反転後のいす型配座の立体構造も書いてみなくても判断できるはずである。
(解答例)
(a) 一方はアキシャルで、もう一方はエカトリアル。
(b) 一方はアキシャルで、もう一方はエカトリアル。
(c) 両方ともアキシャル、または、両方ともエカトリアル。
(d) 一方はアキシャルで、もう一方はエカトリアル。
(e) 両方ともアキシャル、または、両方ともエカトリアル。
(f) 両方ともアキシャル、または、両方ともエカトリアル。
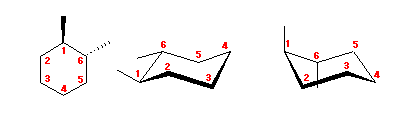
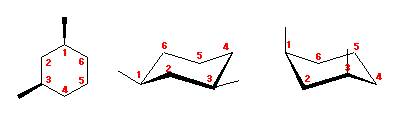
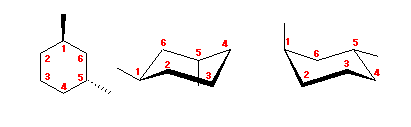
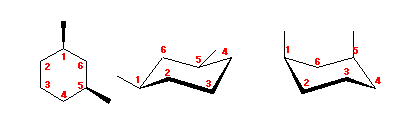
4.43
1,3-dimethylcyclohexane を、2つのいす型の立体配座で書いてみる。
アキシャル位にある置換基は、1,3-ジアキシャル相互作用によるひずみをもたらす。
(解答例)
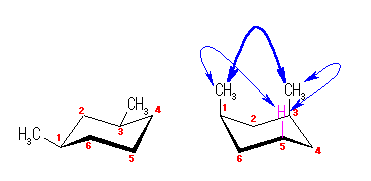
図左のジエカトリアル配座は、1,3-ジアキシャル相互作用によるひずみを持たないのに対し、図右のジアキシャル配座では、水素−メチル間の 1,3-ジアキシャル相互作用が2組と、メチル−メチル間の 1,3-ジアキシャル相互作用をあわせもつため、おおきなひずみエネルギーを持つ。
4.44
4.43 で描いたジアキシャル配座で、ひずみをもたらしているすべての 1,3-ジアキシャル相互作用は何であるかを考える。これらのうち、値が既知であるものを合計のひずみエネルギーより差し引きすると、値が未知の相互作用の大きさが計算できる。
教科書 126ページ、表4.2 を参照すること。
(解答例)
1,3-dimethylcyclohexane のジアキシャル配座では、4.43 の解答例で描いた図のように、水素−メチル間の 1,3-ジアキシャル相互作用が2組(青、矢印)と、メチル−メチル間の 1,3-ジアキシャル相互作用(青、太い矢印)とがある。水素−メチル間の 1,3-ジアキシャル相互作用は、一組につき 3.8 kJ/mol であるから、以下の計算により、メチル−メチル間の 1,3-ジアキシャル相互作用の大きさが求められる。
23 kJ/mol − ( 2 × 3.8 kJ/mol ) = 15.4 kJ/mol
なお、この値は、t-butyl 基( -C(CH3)3 )と水素の間の 1,3-ジアキシャル相互作用よりも大きいことがわかる。
4.45
2つのいす形配座を描き、それぞれのもつ 1,3-ジアキシャル相互作用をすべて数え、これに由来するひずみを計算する。
(解答例)
下図は、4.43 の解答例( 1,3-dimethylcyclohexane のもの)とも見比べてみること。
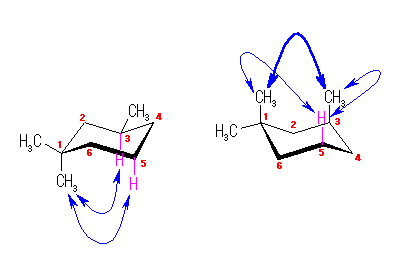
図からあきらかなように、1,1,3-trimethylcyclohexane は、3位のメチル基がエカトリアル位にあるいす形配座と、3位のメチル基がアキシャル位にあるいす形配座とがある。
3位のメチル基がエカトリアル位にあるもの
2組の水素−メチル基間の 1,3-ジアキシャル相互作用があるため、ひずみエネルギーは、
2 × 3.8 kJ/mol = 7.6 kJ/mol である。
3位のメチル基がアキシャル位にあるもの
2組の水素−メチル基間の 1,3-ジアキシャル相互作用、および
メチル基−メチル基間の 1,3-ジアキシャル相互作用があるため、ひずみエネルギーは、
2 × 3.8 kJ/mol + 15.4 kJ/mol = 23.0 kJ/mol である。
これら2つの配座で比較すると、3位のメチル基がエカトリアル位にある方がより安定である。また、これらの間のエネルギー差 ΔE は、15.4 kJ/mol であるから、4.41 と同様の計算を行うと、より不安定な配座である3位のメチル基がアキシャル位にある方の配座は全体の中の 0.21 % を占めるに過ぎないことが求められる。
4.46
「(a) 配座異性体は室温では互いに変換してしまうから区別できないものである、すなわち立体異性体として区別されないと考える」か、「(b) 配座異性体を互いに区別できるものとして立体異性体と考える」かによって、「どの立体異性体が最も安定か」という問いを、「(a) どのシス−トランス異性体が最も安定であるか」、「(b) それぞれのシス−トランス異性体のとる立体配座異性体の中でどれが最も安定であるか」、の二通りに解釈することができる。
しかし、どちらも本質的には同じ内容を訊いていることに注意。
より安定な立体配座をもつ方のシス−トランス異性体が、より安定であるからである。(不安定な方のいす形配座は、その占める割合が少ないはずだから寄与として考えなくて良いから。)
従って、以下のように考える。
1) シクロヘキサン環を正六角形で描いたあと、くさび形の結合で紙面手前または奥側に向かって(あるいは環の上方または下方に向かって)置換基を描き込む。1,3,5位の3つの置換基が同じメチル基だから、対称性が良い。環を120度回したり、裏返したりして重ねることができるものは、互いに同じものであるとみなす。
2) このようにして探し出したシス−トランス異性体(立体配置異性体)のそれぞれに対し、二種類のいす型の立体配座のうち、安定な方を描いて、その全ひずみエネルギーを計算する。
メチル基間の 1,3-ジアキシャル相互作用の大きさは、4.44 を参照すること。
3) より安定ないす形配座をもつ方のシス−トランス異性体(立体配置異性体)が、より安定であると考えることができる。
(解答例)
シス−トランス異性体(立体配置異性体)は、以下の2種類のみが存在する。
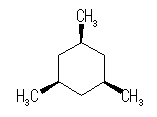 |
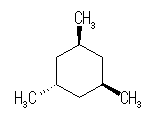 | |
| いす形配座-1 |
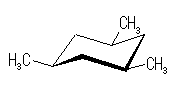 |
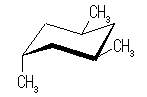 |
| 0 kJ/mol | 2 × 3.8 kJ/mol = 7.6 kJ/mol | |
| いす形配座-2 |
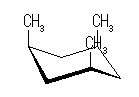 |
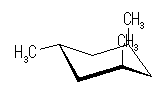 |
| 3 × 15.4 kJ/mol = 46.2 kJ/mol | 2 × 3.8 kJ/mol + 1 × 15.4 kJ/mol = 23.0 kJ/mol |
4.47
cis-decaline と、trans-decaline をシクロヘキサン環がいす形配座となるような方法で描き、分子内にどのような 1,3-ジアキシャル相互作用があるのかを見つけだせばよい。
問題文より、環を構成するメチレンとアキシャル水素との間の1組の 1,3-ジアキシャル相互作用の大きさは 3.8 kJ/mol と近似してよい(エチル基と水素との間の 1,3-ジアキシャル相互作用も、これと近い 4.0 kJ/mol である)ので、この値に相互作用の数を掛ければよい。
4.20 の解答例も参照すること。
(解答例)
trans-decaline は分子内に 1,3-ジアキシャル相互作用を持たないが、cis-decaline では、黒で描いたシクロヘキサンから結合している青の環を構成している CH2 のように、アキシャル位にくる置換基があるとみなせるから、アキシャル水素との間に 1,3-ジアキシャル相互作用を持つ。
黒で描いた環を中心に考えると、アキシャル位の青い CH2 −ピンク水素の2組の 1,3-ジアキシャル相互作用が、また、青で描いた環を中心に考えても同じようにアキシャル位の黒い CH2 −緑の水素の2組の 1,3-ジアキシャル相互作用がある。ところで、図からわかるようにひとつは重複して数えているからこれを考慮すると、総合して3組の 1,3-ジアキシャル相互作用があるので、
3 × 3.8 kJ/mol = 11.4 kJ/mol の 1,3-ジアキシャル相互作用に由来するひずみエネルギーをもつ。
 trans-decaline
trans-decaline
 cis-decaline
cis-decaline
橋頭位の水素は赤い結合で表した。
1,2-二置換シクロヘキサンにおいて、その2つの置換基がジアキシャルでない場合には、置換基間の gauche 相互作用も存在する。すなわち、しかし、cis-、trans-デカリンのいずれにおいてもこの相互作用の大きさは同じであるから、この2つの間の比較をする場合には無視しても良い。
4.48
分子模型を使って実際に反転させてみるのが一番はやい。
4.20 や 4.47 で描かれた trans-decaline は、いずれも橋頭位の水素がアキシャル位に結合しており、したがってもうひとつの環を構成するメチレン( -CH2- )はエカトリアル位にある。もし環を反転させることができるなら、この二つのメチレンはともにアキシャル位にくるはずである。(隣接した炭素のアキシャル水素は、環のなす平面に対して垂直方向で、かつ、上方と下方の反対側に向かって結合している。)
このことを考慮にいれて、「反転後のtrans-decaline 」を描いてみれば判る。
なお、デカリンの環反転による立体配座の変化を、解答例として図で示しておくが、ただ見るだけでは若干判りにくいかもしれない。自分なりに試行錯誤してから図をみること。
(解答例)
 trans-decaline
trans-decaline
青で示した方の環を構成する2つのメチレン( -CH2- )(青C3、青C6)がともに黒のシクロヘキサン環のアキシャル位にあるとき、残り2つの炭素(青C4、青C5)だけではこの2つのメチレンの間をつなぐことができない。(結合角が109.5度であることを思い出すこと。)
従って、トランスデカリンの一方のシクロヘキサン環に接した2つのメチレンは必ずともにエカトリアル位になければならない。このため、反転することができない。
 cis-decaline
cis-decaline
シスデカリンは図のように容易に反転させることが可能である。
4.49
ビシクロ[4.1.0]ヘプタンは、図に示されるように、シクロプロパン環とシクロヘキサン環が1本の炭素−炭素結合を共有しているような二環系の化合物である。
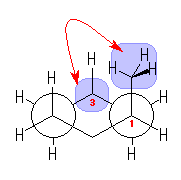
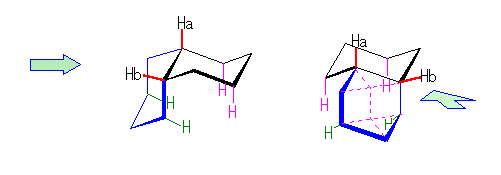
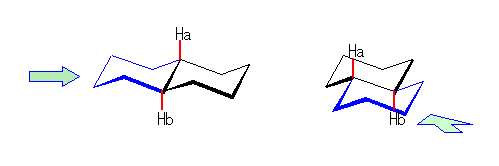
シクロプロパンの立体配座においては、教科書 116ページの図に示されるように、すべての炭素−水素結合は、重なり形をとっている。このことに注意して、ビシクロ[4.1.0]ヘプタンの C1-C6 および C3-C4 方向からみた Newman 投影図を描いてみよ。
(解答例)
左はcis-bicyclo[4.1.0]heptane について、右はtrans-bicyclo[4.1.0]heptane について描いたものである。
まずシクロヘキサン部分をいす形にした配座で描く(上段)と、C1-C6 軸に沿って見た時、この2つの炭素から出ている置換基はねじれ型になることになる。ところが、C1 と C6 の両方から C7 のメチレンへ結合しているから、青で描いた矢印のような回転(C1-C6 軸のまわりのねじれ)により、重なり形配座になる必要がある。
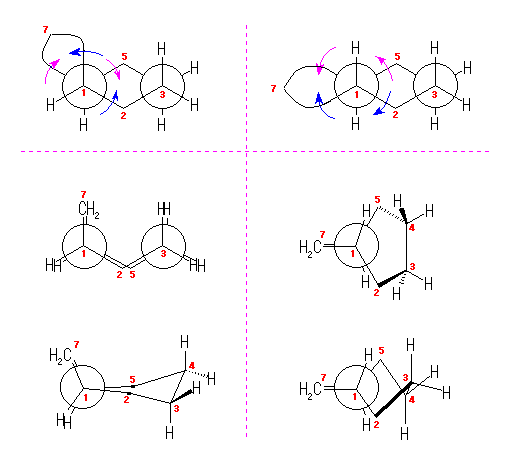
cis-bicyclo[4.1.0]heptane では、配座をいす形から舟形(左、中段)にしたり、下段のような配座など、比較的安定な配座をとることができる。(これらのうち、どれが一番安定であるかは、ここでは議論しない。)
ところが、trans-bicyclo[4.1.0]heptane では、C1-C6 軸について重なり形をとったときに、C2-C1-C6-C5 の二面角が120度となってしまうため、環に非常におおきなひずみが生じる。
このため、bicyclo[4.1.0]heptane は、トランス体よりもシス体の方が安定である。
二環系化合物の命名は以下のように考える。
1) 2つの橋頭炭素の間にある炭素の数を、3本の橋について数える。この数を大きい順にならべたものが ” [a.b.c] ” の部分である。「ビシクロ」と、「全体の炭素数と同じアルカンの名称」の間にこれらの数字をはさむ。←( 数字と数字の間は、コンマではなく、ピリオド )10/17 追記
2) 番号の付け方は、2つの橋頭炭素のうちの一方を1とし、次の一筆書きの順に炭素に番号を振る。すなわち、一番長い橋を渡り反対側の橋頭炭素にいく。次に長い橋を渡りはじめの橋頭炭素に来たのち、最後の一番短い橋を渡る。
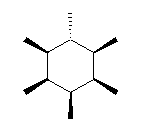
4.50
1) シス−トランスの立体配置異性体を探すのであるから、まず環を(いす形ではなく)平面形に固定して(すなわち正六角形などで)描く。置換基の結合位置は、環に対して上か下かの可能性がある。これは、くさび形の結合などを用いて区別する。
2) すべてのメチル基が環の上方にある場合の立体配置異性体 … 1種類
5つのメチル基が環の上方にある場合の立体配置異性体 … 1種類
というようにすべての立体配置異性体を数える。
3) 最も安定な立体配置は、最も安定な配座として、大きな置換基がアキシャル位にある数がなるべく少ないものをとることが可能なもの。
(解答例)
立体配置異性体は、8種類が考えられる。このうち、一番安定なものは、図一番下のようにメチル基がシクロヘキサン環に対して上下上下上下となっている、すべての隣りあうメチル基がトランスとなっているもので、メチル基がすべてエカトリアル位に結合したいす形配座をとる。
| 立体配置 | 立体配座 | |||
|---|---|---|---|---|
| いす形配座−1 | いす形配座−2 | |||
| 1,3-diaxial interaction | gauche interaction | 1,3-diaxial interaction | gauche interaction | |
| steric strain | steric strain | |||
 |  | |||
| 3 × 15.4 kJ/mol | 6 × 3.8 kJ/mol | 3 × 15.4 kJ/mol | 6 × 3.8 kJ/mol | |
| 69.0 kJ/mol | 69.0 kJ/mol | |||
 |  | |||
| 1 × 15.4 kJ/mol + 2 × 3.8 kJ/mol | 6 × 3.8 kJ/mol | 3 × 15.4 kJ/mol + 2 × 3.8 kJ/mol | 4 × 3.8 kJ/mol | |
| 45.8 kJ/mol | 65.2 kJ/mol | |||
 |  | |||
| 1 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 5 × 3.8 kJ/mol | 1 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 5 × 3.8 kJ/mol | |
| 49.6 kJ/mol | 49.6 kJ/mol | |||
 |  | |||
| 2 × 3.8 kJ/mol | 6 × 3.8 kJ/mol | 4 × 15.4 kJ/mol + 2 × 3.8 kJ/mol | 2 × 3.8 kJ/mol | |
| 30.8 kJ/mol | 76.8 kJ/mol | |||
 |  | |||
| 1 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 4 × 3.8 kJ/mol | 1 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 4 × 3.8 kJ/mol | |
| 45.8 kJ/mol | 45.8 kJ/mol | |||
 |  | |||
| 4 × 3.8 kJ/mol | 6 × 3.8 kJ/mol | 2 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 4 × 3.8 kJ/mol | |
| 38.0 kJ/mol | 61.2 kJ/mol | |||
 光学異性体が存在する |  | |||
| 2 × 15.4 kJ/mol + 4 × 3.8 kJ/mol | 3 × 3.8 kJ/mol | 4 × 3.8 kJ/mol | 5 × 3.8 kJ/mol | |
| 57.4 kJ/mol | 34.2 kJ/mol | |||
 |  | |||
| 0.0 kJ/mol | 6 × 3.8 kJ/mol | 6 × 15.4 kJ/mol | 0.0 kJ/mol | |
| 22.8 kJ/mol | 92.4 kJ/mol | |||
4.51-4.58
4.51
それぞれ、ねじれ形、重なり形の配座について、異なるひずみエネルギーを持つものがありうる場合がある(ねじれ形では gauche 相互作用の有無やその数、重なり形では何と何が重なるか)。
(解答例)
ねじれ形配座においては gauche 相互作用の和が、重なり形配座においては3箇所の重なり形相互作用の和が、それぞれのひずみエネルギーとなる。
| ねじれ形 | 重なり形 | |||
|---|---|---|---|---|
| (a) |
 |
 |
 |
 |
| 3.8 kJ/mol | 7.6 kJ/mol | 18.0 kJ/mol | 21.0 kJ/mol | |
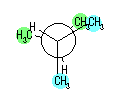
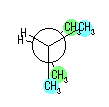
| (b) |
 |
 | ||
| 7.6 kJ/mol | 23.0 kJ/mol | |||
| (c) |
 |
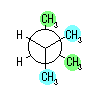 |
 |
 |
| 7.6 kJ/mol | 11.4 kJ/mol | 23.0 kJ/mol | 26.0 kJ/mol | |
| (d) |
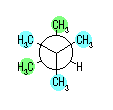 |
 | ||
| 15.2 kJ/mol | 28.0 kJ/mol | |||
4.52
2つのいす形配座のうち、なるべく多くの置換基がエカトリアル位にあるものが安定であると考える。
(解答例)
のように番号を振るとする。
| 置換基 | 立体配座−1 | 立体配座−2 | |
|---|---|---|---|
 | |||
| 1-OH | 上 | エカトリアル | アキシャル |
| 2-OH | 上 | アキシャル | エカトリアル |
| 3-OH | 上 | エカトリアル | アキシャル |
| 4-OH | 下 | エカトリアル | アキシャル |
| 5-OH | 上 | エカトリアル | アキシャル |
| 6-OH | 下 | エカトリアル | アキシャル |
したがって、左の立体配座(−1)のほうが多くの置換基がエカトリアル位にあり、より安定であると考えられる。 (発展)
置換基の位置、種類から環の位置番号が決まっていないときは、cis の番号を優先する。
4.53
メチル基と塩素がともに環の同じ側のアキシャル位にあるとき、メチル基と水素の、塩素と水素の、そしてメチル基と塩素の間の 1,3-ジアキシャル相互作用が存在する。このうち、前の2つは、表 4.2 に数値が載っている。
(解答例)
いす形配座においては、cis-1,3- 位の2つの置換基は、ジエカトリアルまたはジアキシャルの位置にくる。より安定な配座においては、ジエカトリアルなので、分子内にひずみの原因となるような相互作用はない。したがって、2つの置換基がジアキシャルにあるときの、3つの 1,3-ジアキシャル相互作用(メチル基と水素、塩素と水素、メチル基と塩素)の和が安定性の差、15.5 kJ/mol である。
メチル基と水素、塩素と水素の 1,3-ジアキシャル相互作用は、表 4.2 より、3.8 kJ/mol、1.0 kJ/mol であるから、メチル基と塩素の間の 1,3-ジアキシャル相互作用の大きさは、
15.5 − ( 3.8 + 1.0 ) = 10.7 kJ/mol である。
4.54
二重結合は、となりあった2つの sp2 混成した炭素の p 軌道が重なりあって生じている。(教科書 18ページ、図 1.14 炭素−炭素二重結合に軌道の模式図)
1-ノルボルネンの分子において、特に二重結合を構成する2つの炭素について、p 軌道の方向を考えてみること。
(解答例)
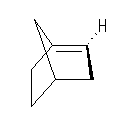
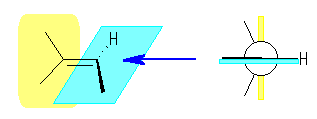
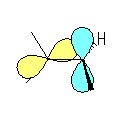
1-norbornene の二重結合の周囲のみとり出してみると、次図のようになる。すなわち、二重結合はおよそ 90度ねじれており、2つの炭素の p 軌道もほぼ直交している。このため、軌道の重なりがないため、安定な二重結合とならない。
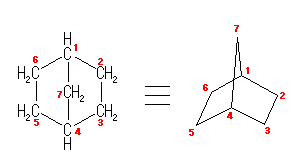
norbornane は、bicyclo 化合物の体系的命名法の下では、bicyclo[2.2.1]heptane となる。(参照、4.49 発展)
4.55
図に、アキシャル位およびエカトリアル位の2つの結合を描き込んでみればよい。
もし環が煩雑でわかりにくければ、注目している炭素を含んだシクロヘキサン環のみを取り出して、教科書の図と合わせたようないす形配座で書いてみてもよい。
(解答例)
図のようになるので、
(a) エカトリアル
(b) アキシャル
(c) エカトリアル
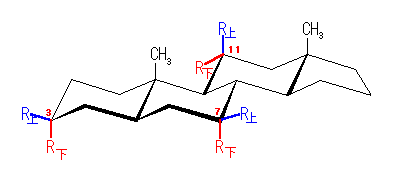
4.56
1) まず、青で描いた6員環について、いす形配座で描いてみる。
2) 次に、この 1,3,5 位より同じ方向(すなわち、互いに cis 配置となるように)3本の結合を書く必要がある。この時、すべてがエカトリアル位にくるように描くと、分子のもつ環の構造を完成できないから、すべてがアキシャル位にくるように描く必要がある。
3) ひとつの6員環につき、環を構成する6本の結合は、「3組の平行線」で描くことを思いだしながら、分子の構造を完成させる。
(解答例)
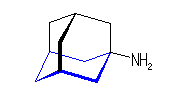
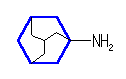
 1) この化合物の骨格は、3箇所に切れ目をいれることにより、完全に環構造をなくすことができるので、「三環式炭化水素, tricycloalkane」である。
1) この化合物の骨格は、3箇所に切れ目をいれることにより、完全に環構造をなくすことができるので、「三環式炭化水素, tricycloalkane」である。 2) 「一番短い橋」を取り除いた、二環式炭化水素である左の化合物は、4.49(発展)で述べたルールにより、bicyclo[3.3.1]nonane と命名される。
2) 「一番短い橋」を取り除いた、二環式炭化水素である左の化合物は、4.49(発展)で述べたルールにより、bicyclo[3.3.1]nonane と命名される。一方の橋頭(C1)から一番長い橋(C2, C3, C4)を通ってもう一つの橋頭(C5)に達し、次に長い橋(同じ長さ:C6, C7, C8)を渡り、最後に3本目の橋(C9)を渡る。橋の長さは、[3.3.1]、全炭素数は9で、同じ炭素数のアルカンは、nonane である。
3) bicyclo[3.3.1]nonane の、3位、7位を、炭素数1の橋で結んだものがもとの三環式炭化水素であるから、これは、tricyclo[3.3.1.13,7]decane という命名となる。
4) この化合物の慣用名は、「adamantane, アダマンタン」である。
4.57
次の3段論法となる。
1) アキシャル位の塩素は、エカトリアル位の塩素にくらべて脱離反応の反応性が高い。
2) tert-butyl 基は、アキシャル位よりもエカトリアル位になりやすい。(エネルギー的には、1,3-ジアキシャル相互作用の大きさで議論できる。表 4.2 )その結果として一方の立体配置異性体においては、塩素がアキシャル位に来る。
3) その立体配置異性体は、脱離反応の反応性が高くなる。(速く反応する。)
(解答例)
tert-butyl 基がアキシャル位を占めたときの水素との 1,3-ジアキシャル相互作用は1組につき 11.4 kJ/mol あるのに対し、塩素がアキシャル位を占めたときの水素との 1,3-ジアキシャル相互作用は1組につき 1.0 kJ/mol である。
このため、cis-1-tert-butyl-2-chlorocyclohexane のように、2つの置換基のうちどちらかがアキシャル位、どちらかがエカトリアル位を占めるような立体配置異性体においては、tert-butyl 基がエカトリアル位にある方が、もう一方に対して 20.8 kJ/mol だけ安定である。これは、ボルツマン分布から考えて、300 K の温度では、 99.98 % の分子でtert-butyl 基がエカトリアル位にあり、塩素がアキシャル位にあることを示す。
trans-1-tert-butyl-2-chlorocyclohexane では2つの置換基がともにエカトリアルになることができ、ジアキシャル体に対し 24.8 kJ/mol だけ安定である。これは、ボルツマン分布から考えて、300 K の温度では、 99.99 % 以上の分子でtert-butyl 基、塩素ともにエカトリアル位にあることを示す。
従って、ほとんどの分子において塩素がアキシャル位にあるcis-体で、より速く脱離反応を示す。
4.58
1) ここでは光学異性体は区別する必要がないから、1つの置換基を環の上または環の下に固定し、残りの2つの置換基が、環の上か下かで立体配置異性体を4種類考えればよい。
2) より大きな置換基である tert-butyl 基がエカトリアル位にくるように、いす形配座で描く。( tert-butyl 基がアキシャル位にくるような立体配座はほとんど存在できない。エネルギー的には、表 4.2 を用いて議論することができる。)
3) 2つの水酸基の酸素を用いた、アセタールの6員環構造を描くことが可能かどうか、考える。
(解答例)
常にエカトリアル位にくる、4位のtert-butyl 基の「上下」を、環の下であるような形に固定して考えることにする。(1位、もしくは 3位の水酸基を固定して考えても、もちろん構わない。ただし、その場合は、常に 4位のtert-butyl 基をエカトリアル位にくるように、適宜、環の反転をおこなってやりながらいす形配座を描くこと。)
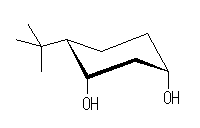
この立体異性体(3つの置換基がすべて同じ方向(下方)を向いているもの。教科書の図と同じ立体異性体。ただし、教科書の図(3つがすべて環の上方にある)とは光学異性体の関係にあるものである。)は、アセタールになり、酸素を2つ含んだ6員環をとることができる。
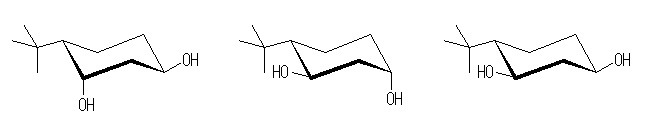
ここに示した3つの立体配置異性体では、水酸基の酸素の間の距離が遠すぎるから、アセタールになることはできない。
環の番号は、4.40 と同様、水酸基の番号が最小になるように振ることを優先する。
なお、解答例で描かなかった4つの異性体は、解答例に示した配座の光学異性体である。